
| |||||||||||||||||||||||||
科目:高中化学 来源:炎德?英才大联考三湘名校2010届高三月考试卷(一) 题型:计算题
(每空3分,共9分)在50mL amol/L的硝酸溶液中,加入6.4gCu,全部溶解,假设 硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO
硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO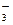 )=3mol/L,
)=3mol/L,
(1)稀释后溶液c(H+)=_____ mol
mol /L。
/L。
(2)若a=9,则生成的气体中NO2的物质的量为____mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO3+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
若将上述的NO2和NO的混合气体通入1mol/L的NaOH恰好被吸收,则NaOH溶液的体积为______mL。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷带解析) 题型:填空题
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
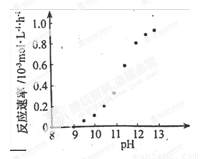
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法: 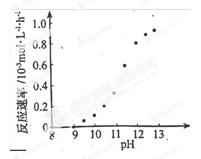
(3)酸浸法制取硫酸铜的流程示意图如下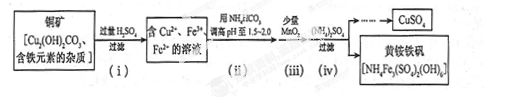
① 步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:实验题
实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3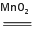 2KCl+3O2↑
2KCl+3O2↑
I.现有下列仪器或装置:
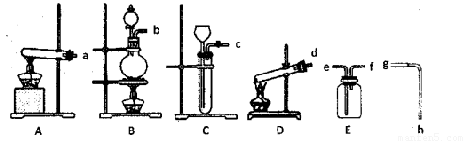
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是____(填序号)。
(2)排水法收集氧气,接口顺序是:氧气出口→___→___→g→h→烧杯(填序号)。
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味。据推测,副产物可能是O3、Cl2、ClO2中的一种或几种。资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2。为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如右装置进行实验:
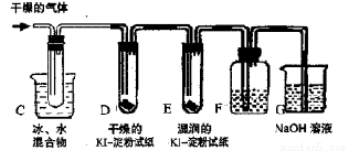
(3)若要确认副产物中含Cl2,F中应盛放_____溶液。
(4)确定副产物中含有ClO2的现象是_________________。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有臭氧的结论?
答:_____ (填“能”或“不能”)。理由是________________________________。
Ⅲ.ClO2是饮用水消毒剂。用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-。为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I- =I2+2ClO2-,反应结束后产生amolI2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I- =2I2+Cl-+2H2O,反应结束后叉产生bmolI2。
(6)饮用水中c(ClO2-)=_____________mol·L- 1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷解析版) 题型:填空题
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:
(3)酸浸法制取硫酸铜的流程示意图如下
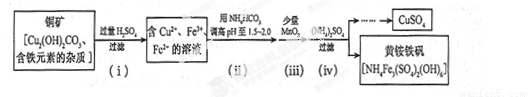
① 步骤(i)中Cu2(OH) 2CO3 发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH = 2.0 , c (Fe3+) =a mol·L-1,, c ( NH4+)=b mol·L-1,, c ( SO42-)= d mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com