
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D
【答案】B
【解析】
A.电石的主要成分为碳化钙,与水反应产生乙炔气体,同时电石中含有杂质硫化钙等,则生成的乙炔气体中混有硫化氢气体,二者均可以与高锰酸钾发生氧化反应使其褪色, 故不能排除硫化氢的干扰,结论不正确,A项错误;
B. CH3COONa中醋酸根离子是弱酸根离子发生水解,CH3COO+ H2O![]() CH3COOH+OH,溶液显碱性,滴入酚酞变红。由于水解是吸热过程,则加热会促进水解,碱性增强,酚酞的红色加深,故可以得出结论CH3COONa溶液显碱性且存在水解平衡,结论正确,B项正确;
CH3COOH+OH,溶液显碱性,滴入酚酞变红。由于水解是吸热过程,则加热会促进水解,碱性增强,酚酞的红色加深,故可以得出结论CH3COONa溶液显碱性且存在水解平衡,结论正确,B项正确;
C.向蔗糖溶液中加入稀硫酸加热一段时间,蔗糖发生水解生成葡萄糖和果糖,若检验葡萄糖,需要在水解产物中加入NaOH溶液调节至碱性环境,然后加入新制Cu(OH)2悬浊液,加热煮沸,观察到由砖红色沉淀Cu2O生成,可证明水解产物中葡萄糖,证明蔗糖发生水解;若水解液仍为酸性环境,会与新制Cu(OH)2悬浊液发生酸碱中和,不会有砖红色沉淀。结论错误,C项错误;
D.向Na2S2O3溶液中滴加H2SO4溶液至过量:S2O32-+2 H+= S↓+ SO2↑+ H2O,一段时间后由淡黄色浑浊出现,同时有无色刺激性气味的气体生成。S2O32-中硫元素化合价+2一部分降到零价发生还原反应,一部分上升到+4发生氧化,故Na2S2O3在该反应中既作氧化剂又做还原剂,结论错误,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
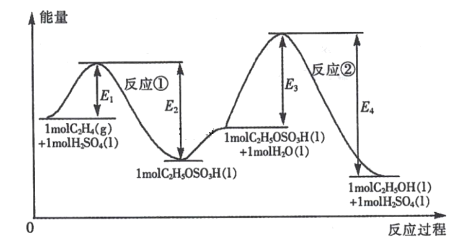
A.H2SO4是该合成过程的催化剂
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10 mg/kg,一种制备黄血盐的工艺如下:
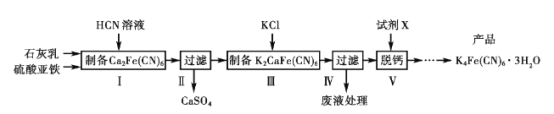
请回答下列问题:
(1)过滤需要用到的玻璃仪器有__________;写出中间产物CaSO4的一种用途__________。
(2)步骤I反应的化学方程式是___________。
(3)步骤V所用的试剂X是________(填化学式),在得到产品前还需经过的步骤包括____。
(4)工艺中用到剧毒的HCN溶液,含CN-等的废水必须处理后才能排放。
①CN-的电子式是_____________。
②处理含CN-废水的方法:第一步NaClO溶液先将CN-不完全氧化为OCN-;第二步NaClO溶液完全氧化OCN-生成N2和两种盐。第二步反应的离子方程式是_____。
(5)已知反应:
3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
现有Fe2+被氧化后的溶液,仅供选择的试剂:铁粉、铁氰化钾溶液、亚铁氰化钾溶液、KSCN溶液,请设计检验Fe2+是否氧化完全的实验方案_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
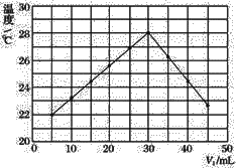
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
C.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
D.用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,开始滴加时就可观察到有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中错误的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是还原剂
D.NH4H固体投入少量的水中,有两种气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用下列方法制取的,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,试回答下列问题:
MnCl2+Cl2↑+2H2O,试回答下列问题:
(1)该反应是氧化还原反应吗?__________(填“是”或“否”),如果是氧化还原反应,请指出__________是氧化剂,______________是还原剂,____________是氧化产物,______________是还原产物,根据上述氧化还原反应判断氧化性:__________>__________;还原性:__________>____________。
(2)写出该反应的离子方程式______________________________。
(3)用双线桥法标出该反应电子转移的方向和数目__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com