
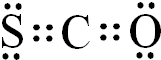 .
.
分析 (1)根据羰基硫分子结构和CO2相似,羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式;
(2)根据图示由元素守恒可知,生成正盐为Na2S、Na2CO3,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,根据电子守恒和原子守恒书写.
解答 解:(1)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为 ,
,
故答案为: ;
;
(2)由图示可知生成正盐为Na2S,由元素守恒可知,生成正盐还有Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:Na2CO3;2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-.
点评 本题考查了物质结构,离子方程式的书写,综合性较强,注意根据信息分析是解答关键,转化关系中的元素守恒来判断产物是解题关键,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
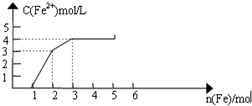 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
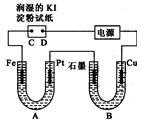 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com