
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
分析 一元弱酸HA溶液中,[H+]为0.2mol/L,可知电离的c(HA)为0.2mol/L,未电离的HA浓度为1.8mol/L,可知溶液中总n(HA)=0.2mol/L+1.8mol/L=2mol/L,进而计算电离度.
解答 解:一元弱酸HA溶液中,[H+]为0.2mol/L,可知电离的c(HA)为0.2mol/L,未电离的HA浓度为1.8mol/L,可知溶液中总n(HA)=0.2mol/L+1.8mol/L=2mol/L,
则电离度为$\frac{0.2}{2}×100%$=10%.
故选A.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力和计算能力,注意把握电离度的计算方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46gNO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 标准状况下,22.4L乙醇完全燃烧后生成的CO2分子数为2NA | |
| C. | 1mol苯中所含的碳碳双键数为3NA | |
| D. | 1mol Cl2与过量Fe反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图均为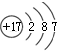 | |
| B. | HCI的形成过程为 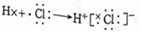 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
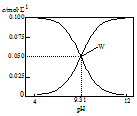
| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com