
| A、苯中含有苯酚(浓溴水,过滤) |
| B、乙酸钠中含有碳酸钠(乙酸,蒸发) |
| C、乙酸乙酯中含有乙酸(饱和碳酸钠溶液,分液) |
| D、溴乙烷中含有醇(水,分液) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.02mL | 18.60mL |
| 第二次 | 0.04mL | 18.66mL |
| 第三次 | 0.20mL | 20.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 生成了BaSO3 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热时有无气体放出 |
| B、滴加盐酸时放出气泡的剧烈程度 |
| C、溶于水后滴加CaCl2稀溶液有无白色沉淀生成 |
| D、溶于水后滴加澄清石灰水有无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
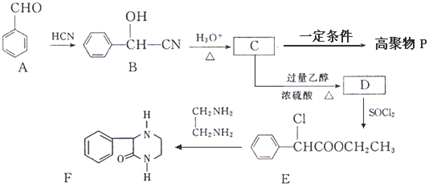
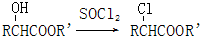 (R,R′代表氢原子或氰基)
(R,R′代表氢原子或氰基)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| C、在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2可以看成:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D、在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com