
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铁粉溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 用 CuSO4溶液吸收 H2S:Cu2++H2S═CuS↓+2H+ | |
| D. | 向 NH4HSO4 溶液中滴加少量的 Ba(OH)2溶液:Ba2++2OH-+NH+H2O+H++SO2-═BaSO4↓+NH3•H2O |
分析 A.用惰性电极电解熔融氯化钠,反应生成金属钠和氯气;
B.铁与稀硫酸反应生成的是亚铁离子;
C.硫酸铜溶液与硫化氢反应生成硫化铜沉淀和硫酸;
D.氢氧化钡少量,氢离子优先反应,铵根离子不反应.
解答 解:A.用惰性电极电解熔融氯化钠,反应生成的是金属钠和氯气,正确的:2Na++2Cl- $\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故A错误;
B.铁粉溶于稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故B错误;
C.用 CuSO4溶液吸收H2S,反应的离子方程式为:Cu2++H2S═CuS↓+2H+,故C正确;
D.向NH4HSO4 溶液中滴加少量的 Ba(OH)2溶液,反应生成硫酸铵、硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
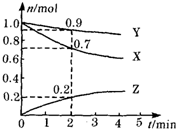 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )| A. | X+3Y=2Z 0.1mol•min-1 | B. | 2X+Y?2Z 0.1mol•min-1 | ||
| C. | X+2Y=Z 0.05mol•min-1 | D. | 3X+Y?2Z 0.05mol•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| D | E |
| A. | A与B形成的阴离子可能有AB32-、A2B42- | |
| B. | AD2分子中每个原子的最外层均为8电子结构 | |
| C. | C和E氢化物的热稳定性和还原性均依次减弱 | |
| D. | A、D、E的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | SiO2是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | CO2通入水玻璃中可得硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
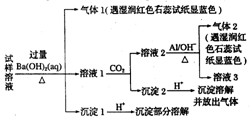 最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】
最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】| A. | 试样中一定存在的阴离子是SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| D. | 试样中可能存在Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度(mol/L) | 甲 | 乙 | 丙 |
| C(H2) | 0.010 | 0.020 | 0.020 |
| C(CO2) | 0.010 | 0.010 | 0.020 |
| A. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| B. | 平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| D. | 改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com