
(1)被还原的H2SO4的物质的量为_____________。
(2)若50 mL浓H2SO4中含溶质为a mol,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)=_____________0.5a mol(填“>”“<”或“=”)。
(3)把题干中反应后的溶液稀释至500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀20.27 g,求原浓H2SO4的物质的量浓度。
科目:高中化学 来源: 题型:
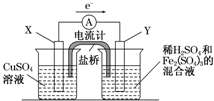 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)2- 4 |
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)将3.2 g Cu与足量的浓硫酸在加热条件下充分反应。
(1)其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为 。
(3)若浓硫酸中含溶质为bmol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4) 0.5 b mol(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高二上学期期中化学(文)试卷 题型:计算题
(6分)将3.2 g Cu与足量的浓硫酸在加热条件下充分反应。
(1)其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为 。
(3)若浓硫酸中含溶质为b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4) 0.5 b mol(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二上学期期中化学(文)试卷 题型:计算题
(6分)将3.2 g Cu与足量的浓硫酸在加热条件下充分反应。
(1)其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为 。
(3)若浓硫酸中含溶质为b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4) 0.5 b mol(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com