
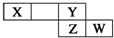
 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
分析 由短周期元素X、Y、Z、W在元素周期表中的相对位置可知,X、Y处于第二周期,Z、W处于第三周期,其中X的最高正价与最低负价绝对值之差等于2,则X处于ⅤA族,故X为N、Y为F、Z为Cl、W为Ar,
A.非金属性越强,氢化物越稳定;
B.高氯酸是最强的无机含氧酸酸;
C.X元素的最简单氢化物与Y元素形成的化合物为氟化铵,氟离子、铵根离子的水解会促进水的电离;
D.根据氢键分析解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的相对位置可知,X、Y处于第二周期,Z、W处于第三周期,其中X的最高正价与最低负价绝对值之差等于2,则X处于ⅤA族,故X为N、Y为F、Z为Cl、W为Ar,
A.非金属性Y>Z,故氢化物稳定性Y>Z,故A正确;
B.高氯酸是最强的无机含氧酸酸,酸性比硝酸强,故B正确;
C.X元素的最简单氢化物为氨气,Y元素为F,二者形成的化合物为氟化铵,氟离子、铵根离子的水解会促进水的电离,故C正确;
D.HF的沸点高于HCl的主要原因是HF存在氢键,与共价键键能无关,故D错误;
故选D.
点评 本题考查了元素周期表和元素周期律的应用,题目难度中等,合理推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容,试题培养了学生灵活应用基础知识的能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题

 (R、R′代表烃基)
(R、R′代表烃基)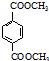 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
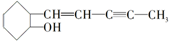 是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )| A. | 该有机物的分子式为C11H16O | |
| B. | 该有机物可以使溴水褪色 | |
| C. | 该有机物易溶于水 | |
| D. | 光照,该有机物可以与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
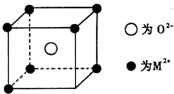 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
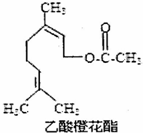
| A. | 该有机物分子式为C12H20O2 | |
| B. | 能发生加成反应和取代反应 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物最多能与2mol NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com