
(14分)滴定法是化学研究中常用的定量实验方法。
⑴某化学兴趣小组用已知浓度的硫酸滴定未知浓度的氢氧化钠溶液测定其浓度。
①实验中应选用的指示剂为 。
②下列操作导致测定结果偏高的有 。
a.酸式滴定管用蒸馏水润洗后未用硫酸润洗
b.锥形瓶用蒸馏水润洗后未用待测氢氧化钠溶液润洗
c.酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失
⑵莫乐法是一种沉淀滴定法.测定某溶液的的c(Cl-),以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液[Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是 。
②该滴定适宜的pH范围是6.5~10.5,若溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2,。下列有关说法你认为正确的有 。
a.若溶液pH<6.5,则平衡Cr2O72-+H2O 2CrO42-+2H+左移,导致滴定终点滞后。
2CrO42-+2H+左移,导致滴定终点滞后。
b.若溶液中有铵盐存在,当pH>7.2时,则因可能生成[Ag(NH3)2]+,导致终点滞后。
c.滴定时应剧烈摇动,促使被AgCl沉淀吸附的Cl-及时释放出来,防止滴定终点滞后。
⑶氧化还原滴定是水环境监测的常用方法可用于测定废水中的化学耗氧量(单位mg/L——每升水样中还原性物质被氧化需O2的质量)。某兴趣小组每次取100mL废水,用硫酸酸化后,加入0.01667mol/LK2CrO7溶液25.00mL,使水样中的还原性物质完全氧化,然后用0.1000mol/LFeSO4标准溶液滴定剩余的Cr2O72-。实验数据记录如下:
| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A.实验室制备乙烯时必须将温度计水银球插入反应液中,测定反应液温度
B.取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖
C.在苯中加入溴水充分振荡、静置,观察现象,判断苯环中是否存在碳碳双键
D.实验室制备乙酸乙酯时,先将乙醇、乙酸混合,再把混合液加入到浓硫酸中
E.除去蛋白质溶液中少量的NaCl,可将装有混合液的半透膜袋放入流水中渗析
F.中和滴定时,酸式滴定管用蒸馏水清洗几次后,即加入标准盐酸进行滴定
G.实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
Ⅱ.储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
![]()
![]()
(1)此反应的氧化剂是______________,氧化产物是______________。
(2)H2SO4在上述反应中表现出来的性质是______________(填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)配平的化学计量数为_________________。
(4)上述反应中若产生0.1 mol CO2气体,则转移电子的物质的量是____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子()。饮用水中ClO2、
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使将溶液中的
还原为
以测定其含量,该反应的离子方程式为:
④若饮用水中的含量超标,可向其中加入适量的
将
还原为
,则该反应的氧化产物为 (填化学式)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期第一次月考化学试卷 题型:实验题
(16分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为

 。
。
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是_ __,图示装置中缺少的一种必须的玻璃仪器是_____________。

②装置A用于溶解产生的二氧化氯气体,其中最好盛放_______(填字母)。
a.20mL 60℃的温水 b.100mL冰水
c.100mL饱和食盐水 d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为______________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。饮用水中ClO2、
)。饮用水中ClO2、 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是____________________________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为_________________
_____________。
以测定其含量,该反应的离子方程式为_________________
_____________。
查看答案和解析>>
科目:高中化学 来源:2010年河南省唐河三高高二下学期期末考试化学试题 题型:实验题
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
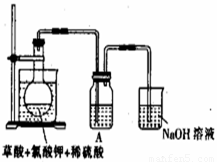
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
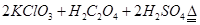
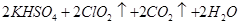
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(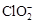 )。饮用水中ClO2、
)。饮用水中ClO2、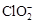 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使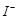 将溶液中的
将溶液中的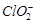 还原为
还原为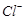 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中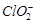 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的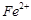 将
将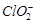 还原为
还原为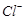 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
查看答案和解析>>
科目:高中化学 来源:09-10年新余一中高二下学期第二次段考化学卷 题型:实验题
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。

(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为


①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(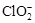 )。饮用水中ClO2、
)。饮用水中ClO2、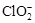 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的 将
将 还原为
还原为 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com