
 有机物M的结构简式如图所示.
有机物M的结构简式如图所示.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
 塑化剂的一种简称DEHP,是由邻苯二甲酸和2-乙基己醇形成的酯类物质,如图是其中一种塑化剂的结构简式.若限制条件:①在苯环上邻位不变;②官能团的种类、位置不变;③苯环上的两个取代基中的一个不变;④可变取代基主链上是碳原子数不变.则DEHP的同分异构体有(不包括图示结构)( )
塑化剂的一种简称DEHP,是由邻苯二甲酸和2-乙基己醇形成的酯类物质,如图是其中一种塑化剂的结构简式.若限制条件:①在苯环上邻位不变;②官能团的种类、位置不变;③苯环上的两个取代基中的一个不变;④可变取代基主链上是碳原子数不变.则DEHP的同分异构体有(不包括图示结构)( )| A、10种 | B、15种 |
| C、18种 | D、19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
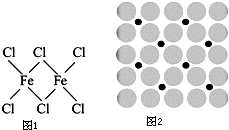 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||

| 元素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键),根据分子结构模型
甲是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键),根据分子结构模型查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铵盐中氮元素化合价都为-3价 |
| B、铵盐与碱共热放出氨气 |
| C、所有铵盐均能分解 |
| D、铵盐中均含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu+4H++SO42-
| ||||
| B、向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | ||||
| C、20mL 1.0mol/L的明矾溶液与10mL 3.5mol/L Ba(OH)2溶液混合充分反应有白色沉淀生成:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | ||||
D、服用阿司匹林过量出现水杨酸( )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: +2HCO3-→ +2HCO3-→ +2CO2↑+2H2O +2CO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com