
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.01mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 明矾 | 食盐 | 石墨 | 醋酸 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| D | KOH | CuSO4 | Na2SO4 | NaClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2 Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4Fe (OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
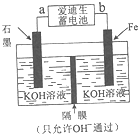 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com