
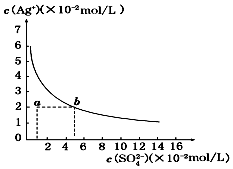
| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
分析 A.Ag2SO4在水中存在溶解平衡;
B.由b点可知Ksp=5×10-2×(2×10-2)2=2×10-5,Qc<Ksp不生成沉淀;
C.b点可知Ksp=c(SO42-)c2(Ag+);
D.蒸发时,c(SO42-)、c(Ag+)均增大.
解答 解:A.Ag2SO4在水中存在溶解平衡,则含有大量SO42-的溶液中肯定存在Ag+,故A错误;
B.由b点可知Ksp=5×10-2×(2×10-2)2=2×10-5,Qc=0.1×(1×10-2)2=10-5<Ksp,可知不生成沉淀,故B正确;
C.b点可知Ksp=c(SO42-)c2(Ag+)=2×10-5,故C错误;
D.蒸发时,c(SO42-)、c(Ag+)均增大,而a点变到b点c(Ag+)不变,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp、Qc的应用、离子浓度变化、溶解平衡为解答的关键,侧重分析与应用能力的考查,注意图象的分析与应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原性(酸性溶液):HCl>CoCl2>HI | B. | 酸性(水溶液):CH3COOH>HCN>H2CO3 | ||
| C. | 热稳定性:KCl<KClO4<KClO | D. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
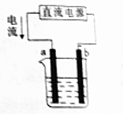
| A. | a为阳极 | |
| B. | 和b相连的电源一极发生还原反应 | |
| C. | 用该装置在铁上镀铜时,b为铁块 | |
| D. | 用该装置点解精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白液中的有效成分是Ca(ClO)2 | |
| B. | 钠呈银白色、质软、熔点相对较低、密度比水小 | |
| C. | 高温下用焦炭还原SiO2制取粗硅 | |
| D. | 二氧化硅是一种熔沸点很高、硬度很大、不溶于水的酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:
现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 除杂试剂 | 方法 | |
| A | CO( CO2) | NaOH溶液 | 洗气 |
| B | FeCl2溶液( FeCl3) | 足量铜粉 | 过滤 |
| C | KNO3(KCl) | -- | 蒸发结晶 |
| D | Al2O3(Fe2O3) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
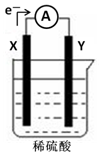 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中电子流向Y→X | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com