
| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
分析 A.一个甲醛分子含有π键与σ键的数目和为4,2个甲醛含有π键与σ键的数目和为8个,1个CH3COOH含有π键与σ键的数目和为8个;
B.依据原子个数守恒判断;
C.核反应属于物理变化;
D.可逆反应正、逆反应同时进行.
解答 解:A.假如60g全部为HCHO,则为2mol,含有π键与σ键的数目和为8mol,假设全部为CH3COOH,则为1mol,1mol乙酸含有π键与σ键的数目和为8mol,所以60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA,故A正确;
B.CH3COOD在水中部分电离生成CH3COO-和D+,H2O部分电离生成H+和OH-,OH-与D+结合生成HDO,所以含有D的有CH3COOD、D+、HDO、OD-,2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中含有D原子共2L×0.5mol/L=1mol,依据原子个数守恒,CH3COOD、D+、HDO、OD-微粒数之和为NA,故B错误;
C.核反应属于物理变化,不属于化学变化,故C错误;
D.将2molSO2与一定量的O2混合一段时间,若该正反应消耗了NA个SO2分子,而逆反应一定会生成二氧化硫分子,则剩余的二氧化硫分子不可能为1mol,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确甲醛、乙酸的结构,熟悉弱电解质电离特点,可逆反应特点是解题关键,注意核反应属于物理变化,题目难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
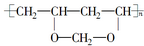 ,它是由聚乙烯醇
,它是由聚乙烯醇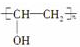 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )| A. | CH3OH | B. | HCHO | C. | HO-CH2CH2-OH | D. | HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
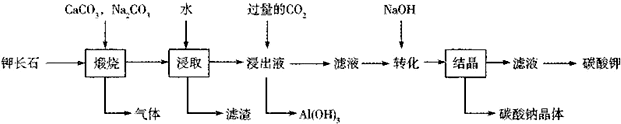
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
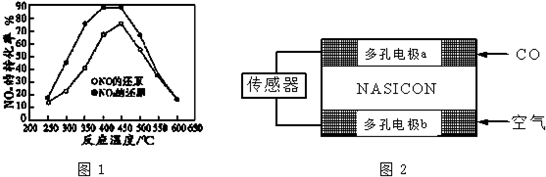
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1.0 mol•L-1Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素中原子半径最大的为Z | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
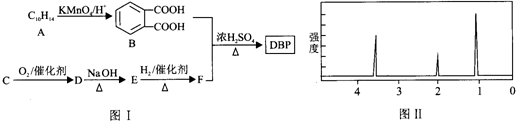
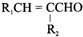 +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基) .
.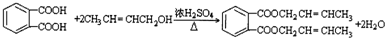 .
.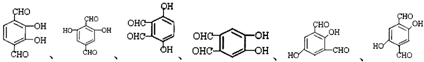 任意2种(填结构简式).
任意2种(填结构简式).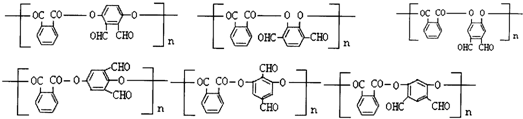 任意一种(填结构简式).
任意一种(填结构简式).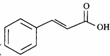 ) 的合成路线
) 的合成路线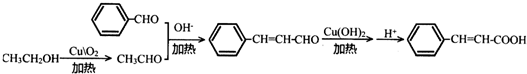 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
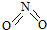 和
和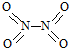 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com