
| A、X原子最外层有5个电子 |
| B、当有1mol X2生成时,共有2mol电子转移 |
| C、氧化产物和还原产物的物质的量之比为5:1 |
| D、“( )”所填的微粒和XO3-在任何环境下都不能共存 |
| 5 |
| 3 |


科目:高中化学 来源: 题型:
| A、24g镁的原子量最外层电子数为NA |
| B、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| C、1mol甲烷分子所含质子数为16NA |
| D、乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有4 NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、蒸馏实验时,蒸馏烧瓶中盛有约
| ||
| B、蒸馏实验时,将温度计的水银球插入液体中 | ||
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | ||
| D、蒸发操作时,应使混合物中剩有少量水份时即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.lmolN2和0.3molH2在一定条件下充分反应,转移电子的数目为0.6NA |
| B、将含0.1mol FeCl3的溶液滴加到沸水中,水解生成胶体粒子数目为0.lNA |
| C、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| D、1L0.1mol?L-1 NaHCO3溶液中含有的阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硝酸与铁反应制取氢气 |
| B、用酒精萃取碘水中的碘 |
| C、用盐酸鉴别苏打和食盐 |
| D、用氢氧化钠溶液与可溶性铝盐制备氢氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的醋酸溶液稀释100倍,pH=5 |
| B、pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol?L-1 |
| C、将1L 0.1mol?L-1的Ba(OH)2溶液稀释为2L,pH=13 |
| D、pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C均为短周期元素组成的物质,其转化关系如下:
A、B、C均为短周期元素组成的物质,其转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
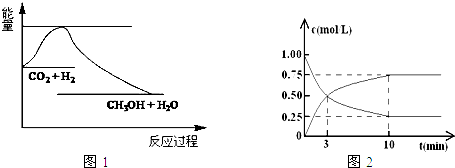
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com