
 Al2O3+6Cu
Al2O3+6Cu  Al2O3+6Cu
Al2O3+6Cu 

科目:高中化学 来源:不详 题型:单选题
| A.氨气是生产硝酸的重要原料 | B.甲烷与氯气反应可制得纯净的一氯甲烷 |
| C.铁制容器可用来盛放稀硝酸 | D.油脂经皂化反应可获得高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+ |
| B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol |
| C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂 |
| D.生铁与浓H2SO4加热反应可产生SO2和CO2气体 |
查看答案和解析>>
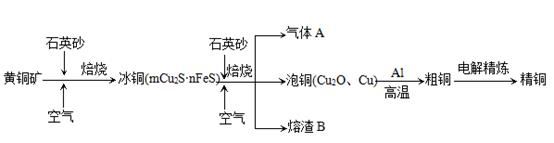
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
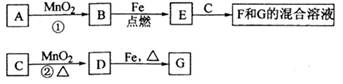
科目:高中化学 来源:不详 题型:填空题
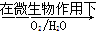 Fe2++SO42-
Fe2++SO42-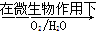 Fe3+
Fe3+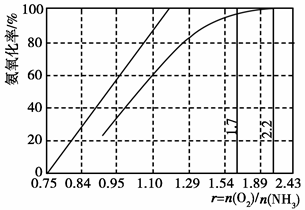
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.前者基本没有改变、后者变棕黄色 |
| B.前者变棕黄色、后者也变棕黄色 |
| C.前者变棕黄色、后者基本没有改变 |
| D.前者、后者都基本没有改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
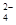 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.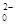
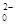 +Hg2Cl2↓
+Hg2Cl2↓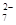 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
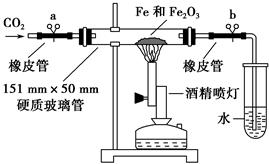
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
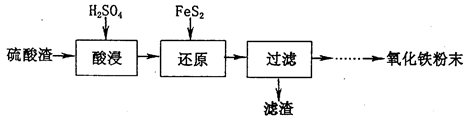
科目:高中化学 来源:不详 题型:填空题
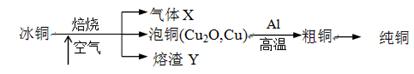
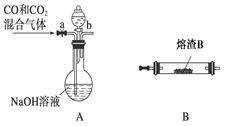

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com