
 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下: 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
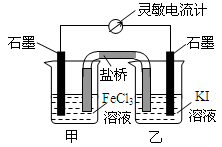
| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
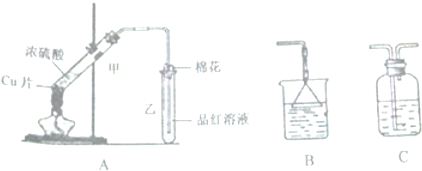
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 柴油、汽油、牛油、植物油等属于烃类物质 | |
| B. | 含五个碳原子的有机物,分子中最多可形成四个碳碳单键 | |
| C. |  是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 | |
| D. | 结构片段为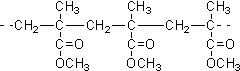 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入几滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$变大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等浓度的:NaHCrO4溶液与NaHCO3溶液中,水的电离程度前者大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com