
 (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: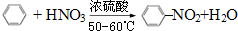 .
.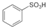 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.分析 (1)①乙烯含有碳碳双键,与溴发生加成反应;
②苯与浓硫酸及浓硝酸在50-60℃时发生取代反应,苯环上的一个氢原子被硝基取代,生成硝基苯和水;
(2)根据质量守恒定律及取代反应的定义确定另一种生成物;
(3)石蜡油分解产物中含乙烯,可被酸性高锰酸钾溶液氧化.
解答 解:(1)①乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
②苯与浓硫酸及浓硝酸在50-60℃时发生取代反应,苯环上的一个氢原子被硝基取代,反应方程式为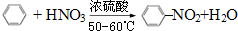 ,
,
故答案为: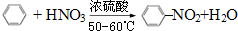 ;
;
(2)苯可以和浓硫酸发生取代反应生成苯磺酸(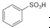 ,发生取代反应,苯中被取代的H与硫酸中-OH结合,由质量守恒定律可知生成水H2O,
,发生取代反应,苯中被取代的H与硫酸中-OH结合,由质量守恒定律可知生成水H2O,
故答案为:H2O;
(3)石蜡油分解产物中含乙烯,可被酸性高锰酸钾溶液氧化,则观察到酸性高锰酸钾溶液紫色褪去,
故答案为:酸性高锰酸钾溶液紫色褪去.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、苯的性质的考查,注意石蜡油分解产物中含乙烯,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 16O2、18O2互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 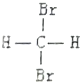 和 和 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应是置换反应 | |
| B. | Cl2是氧化剂 | |
| C. | Fe(OH)3发生还原反应 | |
| D. | 每生成1mol K2FeO4转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2A1 (OH)3↓+CO32- | |
| C. | Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O | |
| D. | 用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用浓硫酸的吸水性和氧化性 | |
| B. | 开始制备气体时应先加热后向烧瓶中加硫酸 | |
| C. | 利用浓硫酸的难挥发性和酸性 | |
| D. | 组装完实验装置立即加试剂、加热制气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0℃,1.01×105Pa时,22.4L空气中所含的N2、O2分子总数为5NA | |
| B. | 100mL 0.1mol/L的硝酸钙溶液中钙离子的数目为0.02NA | |
| C. | 6.5g Zn由原子变为离子时失去的电子数目为0.2NA | |
| D. | 0.012kg的${\;}_{6}^{14}$C中的碳原子数目等于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com