
(1) ėĀ£ØN2H4£©ÓÖ³ĘĮŖ°±£¬ŹĒŅ»ÖÖæÉČ¼ŠŌµÄŅŗĢ壬æÉÓĆ×÷»š¼żČ¼ĮĻ”£·“Ó¦Ź±ŹĶ·Å“óĮæČČ²¢æģĖŁ²śÉś“óĮæĘųĢ唣ŅŃÖŖŌŚ101kPa£¬298KŹ±£¬1molŅŗĢ¬N2H4ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉN2ŗĶĖ®ÕōĘų£¬·Å³öČČĮæ624kJ£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ__________________________ ”£ÓÖÖŖ£ŗH2O(g )£½H2O (l) ”÷H£½£44 kJ·mol£1£¬Čō1molŅŗĢ¬N2H4ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉN2ŗĶŅŗĢ¬Ė®£¬Ōņ·Å³öČČĮæĪŖ__________________kJ”£
(2)ŅŃÖŖ²šæŖ1molH-H¼ü”¢1molN-H¼ü”¢1molN”ŌN¼ü·Ö±šŠčŅŖÄÜĮæŹĒ436KJ”¢391KJ”¢946KJ£¬ŌņN2ÓėH2·“Ӧɜ³ÉNH3µÄČČ»Æѧ·½³ĢŹ½ŹĒ__________________________________”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖľĢæŌŚŅ»¶ØĢõ¼žĻĀÓėÅØĻõĖį·“Ӧɜ³ÉĮ½ÖÖ+4¼ŪµÄŃõ»ÆĪļ£¬ĪŖĮĖĢ½¾æŅ»Ńõ»ÆµŖ(NO)ÄÜ·ńÓė¹żŃõ»ÆÄĘ·“Ó¦£¬ŅŌ¼°·“Ó¦ŗóµÄ²śĪļÖŠŹĒ·ńÓŠŃĒĻõĖįÄĘ(NaNO2)£¬ ijŠ”×éĶ¬Ń§Éč¼ĘĮĖČēĶ¼ĖłŹ¾×°ÖĆ(¼Š³ÖŅĒĘ÷ŗĶĮ¬½ÓÓƵÄČé½ŗ¹ÜŅŃ¾Ź”ĀŌ)”£
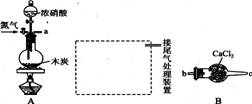

£Ø1£©ĪŖĮĖĶź³ÉøĆŹµŃ飬ŠéĻßæņÄŚ»¹ŠčŅŖĮ¬½ÓB”«EĖÄĢ××°ÖĆ£¬°“ĘųĮ÷·½ĻņĮ¬½ÓµÄĖ³ŠņĪŖa”ś( )( ) ”ś( )( ) ”ś( )( ) ”ś( )( )(ĢīŅĒĘ÷½ÓæŚµÄ×ÖÄø±ąŗÅ)”£Į¬½ÓŗĆŅĒĘ÷£¬¼ģ²éĘųĆÜŠŌ£¬×°ČėŅ©Ę·ŗó£¬ŅŖĶØČėŅ»¶ĪŹ±¼äµÄµŖĘų£¬ŌŁµĪ¼ÓÅØĻõĖį£¬µćČ¼¾Ę¾«µĘ£¬ĶØČĖµŖĘųµÄÖ÷ŅŖÄæµÄŹĒ ”£
£Ø2£©¼ņŹöŹ¹ÓĆ·ÖŅŗĀ©¶·ĻņŌ²µ×ÉÕĘæÖŠµĪ¼ÓÅØĻõĖįµÄ²Ł×÷£ŗ ”£×°ÖĆEÖŠ¹Ū²ģµ½µÄÖ÷ŅŖŹµŃéĻÖĻóÓŠ ”£
£Ø3£©×°ÖĆCµÄ×÷ÓĆŹĒ ”£
£Ø4£©Ä³Ķ¬Ń§¾²éŌÄ׏ĮĻŗó·¢ĻÖŃĒĻõĖįŹĒČõĖį£¬ŠŌÖŹ²»ĪČ¶Ø£¬ŹŅĪĀĻĀŅ×·Ö½ā³ÉŅ»Ńõ»ÆµŖ”£×°ÖĆDÖŠ³ä·Ö·“Ó¦ŗó£¬Éč¼ĘŹµŃéÖ¤Ć÷DÖŠŹĒ·ńÓŠŃĒĻõĖįÄĘÉś³É£ŗ (Š“³ö¼ģŃé²½Öč¼°ĻÖĻó)”£
£Ø5£©ŃĒĻõĖįÄĘŌŚĖįŠŌĢõ¼žĻĀæɽ«IŅ»Ńõ»ÆĪŖI2£¬øĆ·“Ó¦³£ÓĆÓŚŃĒĻõĖįÄĘŗ¬ĮæµÄ²ā¶Ø£¬ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĶ¼ĪŖŌŖĖŲÖÜĘŚ±ķÖŠ¶ĢÖÜĘŚµÄŅ»²æ·Ö£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®·Ē½šŹōŠŌ£ŗY>Z>M
B£®Ąė×Ó°ė¾¶£ŗM£>Z£²£>Y£
C£®ZM2·Ö×ÓÖŠø÷Ō×ÓµÄ×īĶā²ć¾łĀś×ć8µē×ÓĪČ¶Ø½į¹¹
D£®ČżÖÖŌŖĖŲÖŠ£¬YµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĖįŠŌ×īĒæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĪĀ¶ČĻĀ£¬ĻņČŻ»żĪŖ2LµÄĆܱշ“Ó¦Ę÷ÖŠ³äČė0.10 mol SO3£¬µ±·“Ó¦Ę÷ÖŠµÄĘųĢåŃ¹Ēæ²»ŌŁ±ä»ÆŹ±²āµĆSO3µÄ×Ŗ»ÆĀŹĪŖ20%£¬ŌņøĆĪĀ¶ČĻĀ·“Ó¦2SO2(g)£«O2(g)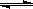 2SO3(g)µÄĘ½ŗā³£ŹżĪŖ£Ø £©
2SO3(g)µÄĘ½ŗā³£ŹżĪŖ£Ø £©
”” A£®400mol£1·L”””””””””” ”””” B£®800mol£1·L
”” C£®1600mol£1·L”””””””” ”” ”” D£®3200mol£1·L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ¹ŲÓŚ0. 10 mol/L NaHCO3ČÜŅŗµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®ČÜÖŹµÄµēĄė·½³ĢŹ½ĪŖNaHCO3=Na++ H++ CO32-
B£®25”ꏱ£¬¼ÓĖ®Ļ”ŹĶŗó£¬n(H+)Óėn( OH-)µÄ³Ė»ż±ä“ó
C£®Ąė×ÓÅØ¶Č¹ŲĻµ£ŗc( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-)
D£®ĪĀ¶ČÉżøߣ¬c(HCO3-)Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A. 1molĀČĘų²Ī¼ÓŃõ»Æ»¹Ō·“Ó¦Ź±µē×Ó×ŖŅĘ2NA
B. 3.2gSO2Óė2.3gNO2Ėłŗ¬ÓŠµÄŃõŌ×ÓŹżĻąµČ
C. 1molNa2O2Óė×ćĮæĖ®·“Ó¦ŗó×ŖŅʵĵē×ÓŹżĪŖNA
D. 1L0.1mol/LMgCl2ČÜŅŗÖŠCl”ŖĄė×ÓŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ£Ø £©
A. ¾ĆÖƵÄĀČĖ®ÓėŠĀÖʵÄĀČĖ®£¬¶¼ÄÜŹ¹ÓŠÉ«²¼ĢõĶŹÉ«
B. ĀČĘų”¢ŅŗĀČŗĶĀČĖ®ŹĒĶ¬Ņ»ÖÖĪļÖŹ
C. µā»Æ¼ŲČÜŅŗÖŠ¼Óµķ·ŪČÜŅŗ±äĄ¶É«
D. ¼ÓµāŃĪ¾ĶŹĒŌŚŹ³ŃĪÖŠ¼ÓČėŹŹĮæµÄµāĖį¼Ų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ»ÆŗĻĪļÖŠŹōÓŚ¹²¼Ū»ÆŗĻĪļµÄŹĒ
A£®NaCl B£®NaOH C£®CH4 D£®(NH4)2SO4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
AÓėBŌŚČŻ»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗaA(s)+bB(g) cC(g)+dD(g)£¬t1£¬”¢t2Ź±æĢ·Ö±š²āµĆ²æ·ÖŹż¾ŻČēĻĀ±ķ£ŗ
cC(g)+dD(g)£¬t1£¬”¢t2Ź±æĢ·Ö±š²āµĆ²æ·ÖŹż¾ŻČēĻĀ±ķ£ŗ
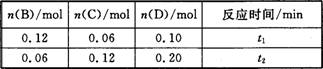
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®0”«t1Ź±¼ä¶ĪÄŚ£¬Ę½¾ł·“Ó¦ĖŁĀŹv(B)=0£®04/t1 mol”¤(L”¤min)-1
B£®ČōĘšŹ¼Ź±n(D)=0£¬Ōņt2Ź±v(D)=0£®20/t2 mol”¤(L”¤min)-1
C£®ÉżøßĪĀ¶Č£¬v(B)”¢vC)”¢v(D)¾łŌö“ó
D£®b£ŗd=6£ŗ1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com