
����Ŀ����Դ�������ѳ�Ϊ�����ѧ�о����ȵ㡣��ش��������⣺
��1������A��ȼ���ȴ���ȼ�ϡ���֪AΪ������Ԫ�أ�����̬ԭ�����ʧȥ1��4���������������������ܣ������ʾ������ԭ�Ӻ�����������㣬���Ԫ��λ�����ڱ�______�壬д��Aȼ�պ��γɵ�������ĵ���ʽ��______��
I1 | I2 | I3 | I4 | �� | |
�����ܣ�kJ/mol�� | 738 | 1451 | 7733 | 10540 | �� |
��2����ͼ�dz�������Ԫ�������ڱ��еķֲ�������Ԫ�صĶ�����Ԫ����ԭ�Ӱ뾶������______����Ԫ�ط��ţ�����ԭ���������______���˶�״̬��ͬ�ĵ��ӣ�д��������������Ӧˮ������ˮ��Һ�еĵ��뷽��ʽ��______��
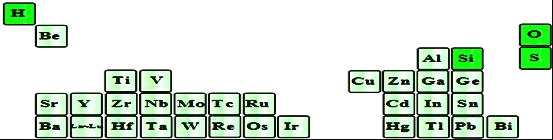
��3����������Ԫ����������ԭ�ӿ����γɵ���˷��ӣ��仯ѧ�������ͼ��Ƕ���ȣ���÷��ӵĿռ乹��Ϊ______��������Ϊ______���ӣ�ѡ����ԡ��Ǽ��ԡ�����
��4���������ڸ����»���ˮ������Ӧ����һ�ֺ�ɫ�����һ����ȼ�����壬��ÿ����1mol����ȼ����ų�37.68kJ��������д���˷�Ӧ���Ȼ�ѧ����ʽ��______��
��5��ȡ����Al��Mg�Ͻ���Ʒ�����ձ��У�����20mL 1mol/L��NaOH��Һ��ǡ����ȫ��Ӧ������������ȷ����______��ѡ���ţ���
a��Mg��������Al������
b�����������20mL 1mol/L�����ᣬ��ų������������ʵ�������2/3
c������NaOH�е�H����D��DΪ���⣩�����ɵ�������D��H���ʵ���֮��Ϊ1��2��
���𰸡���A ![]() Al 3 H++AlO2-+H2O
Al 3 H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- �������� �Ǽ��� 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=��150.72kJ/mol b
Al3++3OH- �������� �Ǽ��� 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=��150.72kJ/mol b
��������
(1)���������ܵı仯�����ж�Ԫ�����࣬MgO�����ӻ������þ�����������ӹ��ɣ�
(2)����ԭ�Ӱ뾶�ı仯�����ж�ԭ�ӣ�ԭ�Ӻ���û���˶�״̬��ͬ�ĵ��ӣ�����������ˮ��Һ�д�����ʽ�������ʽ���룻
(3)����ԭ�ӵĹ��ɺͳɼ��ص������
(4)�������ڸ����»���ˮ������Ӧ����Fe3O4��H2����д����Ӧ����ʽ���ټ��㷴Ӧ�ȣ����д���Ȼ�ѧ����ʽ��
(5)a. Al������������Һ��Ӧ����Mg����Ӧ��b. ���ݷ�Ӧ����ʽ���㣻c. ����Al�����Һ��Ӧ�ı��ʷ�����
(1)��Ԫ�صĵ��������ܾ�����˵��������������Ϊ2�����ڵڢ�A�壬�Ҵ��ڵ������ڣ���ΪMgԪ�أ�����������ȼ������MgO����þ�����������ӹ��ɣ�����ʽΪ��![]() ���ʴ�Ϊ����A��
���ʴ�Ϊ����A��![]() ��
��
(2)ͬ����Ԫ�ص�ԭ���������ԭ�Ӱ뾶��С��һ����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͼ�еĶ�����Ԫ����Al��ԭ�Ӱ뾶���ԭ�Ӻ���û���˶�״̬��ͬ�ĵ��ӣ��������3�����ӣ����������3���˶�״̬��ͬ�ĵ��ӣ�����������ˮ��Һ�д�����ʽ�������ʽ���룬���뷽��ʽΪ��H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-��
Al3++3OH-��
(3)��������Ԫ����������ԭ�ӿ����γɵ���˷��ӣ��仯ѧ�������ͼ��Ƕ���ȣ��÷���ΪSiH4��Ϊ�������幹�ͣ����ڷǼ��Է��ӣ��ʴ�Ϊ���������壻�Ǽ��ԣ�
(4)�������ڸ����»���ˮ������Ӧ����Fe3O4��H2��������Ӧ��3Fe+4H2O(g)![]() Fe3O4+4H2 ������4mol�����ų�����Ϊ37.68kJ��4=150.72kJ�����Ȼ�ѧ����ʽΪ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol���ʴ�Ϊ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol��
Fe3O4+4H2 ������4mol�����ų�����Ϊ37.68kJ��4=150.72kJ�����Ȼ�ѧ����ʽΪ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol���ʴ�Ϊ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H=-150.72kJ/mol��
(5)a. Al������������Һ��Ӧ����Mg����Ӧ����AlΪ��������a����
b. NaOH���ʵ���Ϊ0.02L��1mol/L=0.02mol����2Al+2NaOH+2H2O=2NaAlO2+3H2����֪��AlΪ0.02mol����������Ϊ0.03mol�����������20mL 1mol/L�����ᣬþ���������ϡ���ᷴӦ��HClΪ0.02mol����2Al+6HCl=2AlCl3+3H2����֪HCl���㣬����Hԭ���غ��![]() �����Էų������������ʵ�������
�����Էų������������ʵ�������![]() ����b��ȷ��
����b��ȷ��
c. Al�����Һ��Ӧ�ı�����Al����ˮ��Ӧ���������������������������������������Ʒ�Ӧ��ƫ��������ˮ�������е���Ԫ������ˮ������������DԪ�أ���c����
�ʴ�Ϊ��b��


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�÷ֱ����ʵ�飬��ش��������⣺

ʵ�� | A���Լ� | B���Լ� | C��Һ�� |
I | ����ʳ��ˮ | ��ʯ | H2O |
II | Ũ��ˮ | NaOH���� | CCl4 |
III | ���� | H2O | |
IV | NaOH��Һ | þ���Ͻ� | H2O |
��1������E�������ǣ�____________________��_________________��
��2��ʵ��I��ƿB�з�����Ӧ�Ļ�ѧ����ʽ��________�����������徭�鴿���ȼ��������___________��
��3��ʵ���ʣ���NH3�����մ��������¸���β������װ���У����ܷ�ֹ��������___________��

��4��ʵ��III��ʵ��Ŀ������֤�����ڳ�ʪ�����лᷢ��������ʴ����A���Լ���ѡ��__________������ţ�;
a NaOH��Һ b C2H5OH c NaCl��Һ d ϡ����
��֤�������ڳ�ʪ�����лᷢ��������ʴ��������_________;
��5��д��ʵ��IV�з�����Ӧ�����ӷ���ʽ_________��������ʱC��Һ�����D��Һ�棬������þ���Ͻ���þ������������_______������ƫ��������ƫ����������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������õķ���ʴ�ԣ��ڹ�����ҵ���зdz���Ҫ�����á����������գ�
��1����ԭ�Ӻ����������___�ֲ�ͬ����չ������___�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2���أ�Ga������ͬ�塣д���ص��Ȼ���Ͱ�ˮ��Ӧ�Ļ�ѧ����ʽ___��
��3��������ͬ���ڡ�SiO2�ǹ����β�����Na2CaSi6O14������Ҫ�ɷ֣�Na2CaSi6O14Ҳ��д����������ʽ___��ʢ��NaOH��Һ���Լ�ƿ���ò���ƿ�������γ�ճ�ԵĹ����ζ�����������Ӧ�Ļ�ѧ����ʽΪ___����ʯ���������ᣬ��ͬ�ʯ����ԭ�ӵ����ʵ���������ͬ�����Ƴ�ʯ��ѧʽNaAlSi3O8����֪�Ƴ�ʯ�Ļ�ѧʽΪ___��
��4�������ͽ��������ﷴӦ�Ʊ����������ǹ�ҵ�ϳ��õķ������磺2Al��4BaO![]() 3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
a������ʱAl�Ļ����Դ���Ba b������������BaO�ֽ�
c������ʱBaOAl2O3��Al2O3�ȶ� d��Ba�ķе��Al�ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CH4(g)��2O2(g)= CO2(g)��2H2O(l)�� ��H����890kJ/mol����һ������CH4 (g) ��ȫȼ������CO2(g)��H2O(l) ���ų�������Ϊ74kJʱ������Ҫ�����ڱ���µ����ԼΪ��������N2:O2�����Ϊ4:1�ƣ� �� ��
A.37.24LB.18.62LC.9.3LD.20.50L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��㷺����ȼ�ϵ�ص�ȼ�ϣ�������Ȼ�����ϳɣ���֪��
��2CH4(g)��O2(g)===2CO(g)��4H2(g) ��H����71 kJ/mol
��CO(g)��2H2(g)===CH3OH(l) ��H����90.5 kJ/mol
��CH4(g)��2O2(g)===CO2(g)��2H2O(l) ��H����890 kJ/mol
�������ܵó��Ľ�����(�� ��)
A.��Ӧ�ڲ���Ҫ���Ⱦ��ܽ���
B.CO(g)��2H2(g)===CH3OH(g) ��H����90.5 kJ/mol
C.�״���ȼ������H����764 kJ/mol
D.��CO��ȼ������H����283.0 kJ/mol����H2��ȼ������H����285.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ��������ת����ͼ��ʾ��

(1)����������մ��Ƥ���ϣ�����0.2mol/L CuSO4��Һ��ϴ�����ݲ������жϣ�1mol CuSO4���������İ������ʵ���Ϊ______��
(2)������У���Ӧ��ı�����ͬ�ɻ�ò�ͬ�IJ����Ca3(PO4)2����ܵIJ��ﻹ��______��
��ʯ�������ʵ�ԭ�ϣ�������ɿ��Կ�����Ca3(PO4)2��CaF2��CaSO4��CaCO3��SiO2�Ļ�������Ԫ�صķ���������£���Ԫ�ؾ�����������ʽ��ʾ����
�ɷ� | CaO | P2O5 | SO3 | CO2 |
����������%�� | 47.30 | 28.40 | 3.50 | 6.10 |
(3)��ʯ�У�̼Ԫ�ص���������Ϊ______%��������λС������
(4)ȡ100g��ʯ��ĩ������������Ũ���ᣬ�����ȣ���Ԫ��ȫ����CaSO4����ʽ���ڣ����Եõ�CaSO4______g��������λС������
(5)ȡm g ��ʯ��ĩ����50.00mL������Һ������Ϊ0.5mol/L������Ϊ0.1mol/L�����䷴Ӧ�����Ca��S��PԪ��ȫ����CaSO4��Ca(H2PO4)2����ʽ���ڣ���m��ֵ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��10mLpH=11�İ�ˮ��ˮϡ����100mL�������ж���ȷ����
A.ϡ�ͺ���Һ��pH=7B.��ˮ�ĵ����������Һ���������ӵ�Ũ�Ⱦ���С
C.ϡ������![]() ����D.pH = 11��ˮ��Ũ��Ϊ0.001mol/L
����D.pH = 11��ˮ��Ũ��Ϊ0.001mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ��������ʹҩ������������һ�ֺϳ�·�ߣ�

��֪������![]() ���Ļ�ѧ�����뱽���ơ�
���Ļ�ѧ�����뱽���ơ�
���������գ�
(1)��Ӧ(1)�ķ�Ӧ������___��A�ķ���ʽ��___��
(2)��Ӧ(2)���Լ���������___����Ӧ(3)�IJ�����D��___���ѧʽ����
(3)������������С�մ�ͬʱ���õ�ԭ����___���û�ѧ����ʽ��ʾ����
(4)X��Dһ��ͬ���칹�壬���������ص㣺
�������������������ȡ��������ͬһ�������ϣ�����NaOH��Һ����ȫˮ�⣬��������ˮ���������5�ֻ�ѧ������ͬ���⡣д��X���ܵĽṹ��ʽ___��
(5)���ñ���CH3COClΪԭ�Ϻϳɱ���ϩ�������Լ���ѡ��___��
���úϳ�·������ͼ��ʾΪ��A![]() B��
B��![]() Ŀ������
Ŀ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ�٣�CO(g)��CuO(s) ![]() CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s) ![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g) ![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
A.��Ӧ�ٵ�ƽ�ⳣ��K1��![]()
B.��Ӧ�۵�ƽ�ⳣ��K��![]()
C.���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�ӦΪ���ȷ�Ӧ
D.���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com