
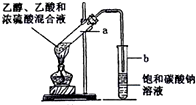
 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.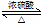 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)检验装置气密性时,先将导管末端插入水中形成密闭系统,根据压强变化分析;
(3)浓硫酸起到了催化作用和吸水作用;
(4)A.液体混合物加热要防止爆沸;
B.碳酸钠溶液能与乙酸反应;
C.乙酸乙酯是一种无色透明、密度比水小的油状液体;
D.若用CH3CH218OH和CH3COOH发生酯化反应,原理是:酸脱羟基醇脱氢.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为:CH3COOH+C2H5OH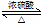 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH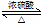 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
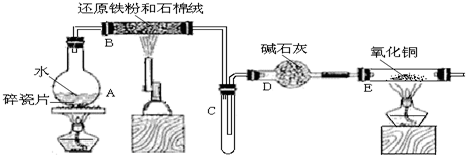
(2)检验装置气密性时,先将导管末端插入水中形成密闭系统,用手捂住试管a,若导管口出现气泡,片刻后松开手,导管末端形成一段稳定水柱,则气密性良好;
故答案为:连接好装置,将导管末端插入水中,用手捂住试管a,若导管口出现气泡,片刻后松开手,导管末端形成一段稳定水柱,则气密性良好;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
(4)A.液体混合物加热要防止爆沸,向a试管中加入沸石,其作用是防止加热时液体暴沸,故A正确;
B.碳酸钠溶液能与乙酸反应,所以饱和碳酸钠溶液可以除去产物中混有的乙酸,故B正确;
C.乙醇与乙酸反应生成的乙酸乙酯,乙酸乙酯是一种无色透明、密度比水小的油状液体,故C错误;
D.若用CH3CH218OH和CH3COOH发生酯化反应,原理是:酸脱羟基醇脱氢,乙酸乙酯中含18O,故D错误;
故答案为:AB.
点评 本题考查了乙酸乙酯的制备,注意把握乙酸乙酯的制备原理和实验方法,把握乙酸乙酯与乙酸、乙醇性质的区别,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
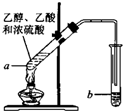 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
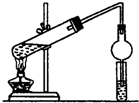 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.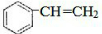 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为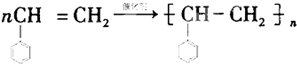 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
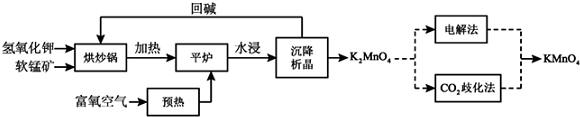
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
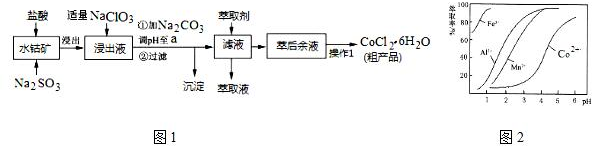
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com