
常温下,下列各组离子能够大量共存的是
A.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B.使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO32-
C.滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32-、NO3-
D.水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、HCO3-、Cl-、NH4+
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101Kpa时,1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 。
②Co(OH)2在空气中加热时,固体残留率随温度的变化, 如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(化学式)在350~400℃范围内,剩余固体的成分为 。(填化学式)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列物质的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:实验题
(10分)(a)铁元素在人类生活中扮演着非常重要的角色,不仅仅是重要的建筑材料,也是人体必须的微量元素。每年钢铁的腐蚀带来巨大的经济损失。某校研究小组在实验室中模拟钢铁在自然环境下的腐蚀,设置如下装置,几天后观察结果:
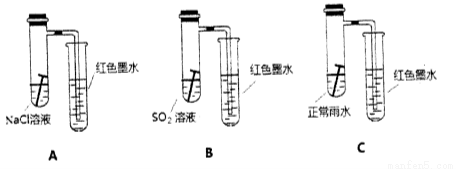
请回答下列问题:
(1)请比较以上三个装置中右侧导管中红墨水的高度: > > 。请写出A装置中,钢铁锈蚀时正极反应的电极反应式 。
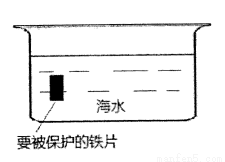
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护,现请你从电化学角度设计一种方法保护下图中钢铁以免被腐蚀,请将下图完成:
(b)下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+:33%~36%,不溶于水但能溶于人体中的胃酸,与Vc(维生素C)同服可增加本品吸收。某乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为:
5 Fe2++8H++MnO4-=5 Fe3++Mn2++4H2O
准确称量上述药品10.00g,将其全部溶于试剂1中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(3)该实验中的试剂1是 (填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(4)请简述判断滴定终点的现象: 。
(5)请通过计算,说明该药品含铁量是否合格 (填“合格”或“不合格”)(Fe的摩尔质量为56g/mol)
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(15分)有以下六种元素:A是宇宙中最轻的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3P轨道后,3P轨道呈全充满状态。G原子2P轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数差8.
L位于周期表第四周期、第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示,
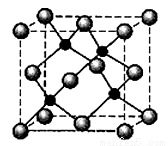
请回答下列问题:
(1)E元素的电负性____________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能____________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是___________(填“极性”或“非极性”)分子。
(4)L的外围电子排布式为____________,该元素位于周期表中的____________族。
(5)R的化学式为________________(用元素符号表示),属于____________晶体。
已知R晶体的密度为ρ g.cm-3,则该晶胞的边长a____________cm。(阿常数用NA表示)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,浓的硝酸以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是________________;(用离子方程式表示):
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 _______ 。(用化学式表示)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少的 ____。原因是: ______________(用离子方程式表示) 。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀 (填化学式),生成该沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源:2016届山西省校高三上学期阶段性考试化学试卷(解析版) 题型:推断题
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,
请按要求回答下列问题。
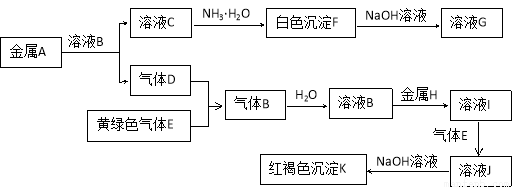
(1)金属A元素在周期表的位置是 ,G的化学式是__________。
(2)写出反应“C→F”的离子方程式 ;
(3)写出反应“I→J”的离子方程式 ;
(4)写出金属 H与水蒸气在高温下反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省西安市高一上10月月考化学试卷(解析版) 题型:选择题
化学工作者从有机反应:RH+Cl2(g) RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是
A.蒸馏法 B.水洗分液法 C.升华法 D.有机溶剂萃取法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com