
分析 (1)Cu元素的化合价由0价→+2价,一个Cu失去2个电子,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,并根据原子守恒配平;
(2)反应中KMnO4中的锰元素由+7价降为+4价,化合价降低3价,K2SO3中的硫元素由+4价升高为+6价,化合价升高2价,所以得失电子的最小公倍数为6,所以
KMnO4的计量数为2,K2SO3的计量数为3,并根据原子守恒配平;
(3)反应中Fe(OH)3中的铁元素由+3价升高到+6价,化合价升高3价,Cl2中的氯元素由0价降低到-1价,化合价降低2价,根据化合价升降守恒,故最小公倍数为6,所以所以Fe(OH)3的计量数为2,Cl2的计量数为3,并根据原子守恒配平;
(4)H2O2中氧元素化合价由-1价降低为H2O中-2价,化合价降低2价;Cr2(SO4)3中铬元素化合价由+3价升高为K2CrO4中+6价,化合价升高6价,化合价升降最小公倍数为6,故Cr2(SO4)3系数1,再结合原子守恒,配平各物质的系数.
解答 解:(1)Cu元素的化合价由0价→+2价,一个Cu失去2个电子,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,并根据原子守恒配平,故方程式3Cu+8HNO3=3 Cu(NO3)2+2 NO↑+4H2O.
故答案为:3;8;3;2;4
(2)反应中KMnO4中的锰元素由+7价降为+4价,化合价降低3价,K2SO3中的硫元素由+4价升高为+6价,化合价升高2价,所以得失电子的最小公倍数为6,所以
KMnO4的计量数为2,K2SO3的计量数为3,并根据原子守恒配平故方程式为2KMnO4+3K2SO3+H2O=2MnO2+3K2SO4+2KOH.
故答案为:2;3;1;2;3;2
(3)反应中Fe(OH)3中的铁元素由+3价升高到+6价,化合价升高3价,Cl2中的氯元素由0价降低到-1价,化合价降低2价,根据化合价升降守恒,故最小公倍数为6,所以所以Fe(OH)3的计量数为2,Cl2的计量数为3,并根据原子守恒配平,故方程式为:2Fe(OH)3+10NaOH+3Cl2=2Na2FeO4+6NaCl+8H2O
故答案为:2;10;3;2;6;8
(2)H2O2中氧元素化合价由-1价降低为H2O中-2价,化合价降低2价;Cr2(SO4)3中铬元素化合价由+3价升高为K2CrO4中+6价,化合价升高6价,化合价升降最小公倍数为6,故Cr2(SO4)3系数1,H2O2系数3,再结合Cr原子守恒,则K2CrO4系数为2,根据SO42-守恒,则K2SO4系数为3,根据K原子守恒,则KOH系数为10,故方程式为3H2O2+Cr2(SO4)3+10KOH=3K2SO4+2K2CrO4+8H2O.
故答案为:3;1;10KOH;3;2;8
点评 化学方程式的配平方法有多种,如观察法、定一法、奇数配偶法、最小公倍数法等.在进行化学方程式的配平时,可以适当选择相应的方法,也可以多种方法并用,本题考查了氧化还原反应方程式的配平,根据氧化还原反应中得失电子数相等配平即可,注意还原剂部分被氧化和氧化剂部分被还原.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:实验题

 CO2+4HCl.
CO2+4HCl.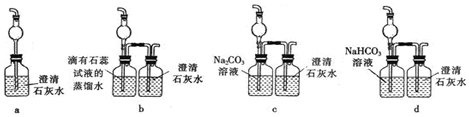
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第二周期的元素 | B. | a一定比b小 | ||
| C. | b-a+m+n一定等于16 | D. | Y只能是第三周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
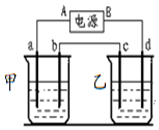 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
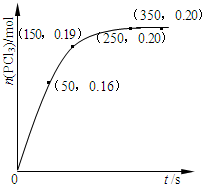 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com