
(14分)碳及其化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)已知:①2CH4(g)+3O2(g) 2CO(g)+4H2O(l) △H1=-1214.6kJ/mol
2CO(g)+4H2O(l) △H1=-1214.6kJ/mol
②2CO(g)+ O2(g) 2CO2(g) △H2=-566kJ/mol,
2CO2(g) △H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为 。
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+ H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是 。
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是 。

(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)  CO2(g)+H2(g);△H得到如下三组数据:
CO2(g)+H2(g);△H得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | D | t |
①实验1中以v(H2)表示的反应速率为 。
②实验2中的平衡常数是 (计算结果保留两位小数)。
③该反应的△H 0(填“>”或“<”)。
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系
是 (用含a、b的式子表示)。
(14分)(每空2分)
(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H= ﹣890.3 kJ/mol
(2)①CD ②增加了催化剂
(3)①0.16mol?(L?min﹣1) ②0.17 ③<0 ④b=2a或a:b=1:2
【解析】
试题分析:(1)根据盖斯定律,将已知热化学方程式相加后除以2,可得所求热化学方程式,所以甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H= ﹣890.3 kJ/mol;
(2)①A、达平衡时,氢气的逆反应速率是甲烷正反应速率的3倍,错误;B、水蒸气的浓度与一氧化碳的浓度相等的状态不一定是平衡状态,错误;C、该反应是气体物质的量发生变化的可逆反应,所以气体平均相对分子质量随时间变化,达平衡时不随时间的变化而变化,正确; D. 该反应在恒温恒压下密闭容器中进行,所以容器的体积会发生变化,则气体的密度也发生变化,达平衡时密度不随时间的变化而变化,正确,答案选CD;
②与实验a相比,b与a达到相同平衡状态,但达平衡的时间缩短,说明反应速率加快,所以b是使用了催化剂;
(3)①实验1中二氧化碳的物质的量增加1.6mol,则氢气的物质的量也增加1.6mol,所以以v(H2)表示的反应速率为1.6mol/2L/5min=0.16mol?(L?min﹣1);
②实验2中平衡时二氧化碳的物质的量浓度均是0.4mol/2L=0.2mol/L,CO的浓度是1.6mol/2L=0.8mol/L,水蒸气的浓度是(1mol-0.4mol)/2L=0.3mol/L,则该温度下反应的平衡常数
K=(0.2mol/L×0.2mol/L)/( 0.8mol/L×0.3mol/L)=0.17;
③实验1与2相比,反应物浓度增大1倍,若温度相同,则平衡时二氧化碳物质的量实验1是实验2的2倍,现在温度降低,二氧化碳物质的量实验1是实验2的1.6/0.4=4倍,说明降低温度,平衡正向移动,所以该反应是放热反应,△H<0;
④实验3与实验2属于恒温恒压条件,达到相同的平衡状态,则只需反应物的量对应成比例即可,实验2中CO与水蒸气的物质的量之比是1:2,所以实验3中a与b之比为1:2,即b=2a。
考点:考查盖斯定律的应用,化学平衡的判断,反应速率、平衡常数的计算,不同条件平衡的比较,等效平衡的应用


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列各物质中,不能满足“ ”转化关系的一组是
”转化关系的一组是
X | Y | Z | |
A | Si | SiO2 | Na2SiO3 |
B | HNO3 | NO | NO2 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | Cu | CuO | CuSO4 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是

A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:填空题
(16分)氨、硝酸、硝酸铵、硝酸铜是重要的化工产品。工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)吸收塔中通入空气的作用是 。
下列可以代替硝酸镁加入到蒸馏塔中的是 。
A.浓硫酸 B.氯化钙 C.生石灰 D.硝酸亚铁
(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为:NO、NO2混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出反应的化学方程式 、 。
(3)在氧化炉里,催化剂存在时氨气和氧气反应:
4NH3 + 5O2 4NO + 6H2O 4NH3 + 3O2
4NO + 6H2O 4NH3 + 3O2 2N2+ 6H2O
2N2+ 6H2O
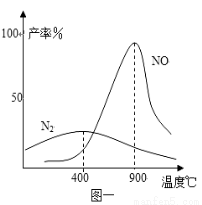
在不同温度时生成产物如图一所示。在氧化炉里,反应温度通常控制在800℃~900℃的理由是 。

(4)如图二所示装置可用于电解NO制备 NH4NO3,电解总反应方程式为 ,需补充氨气的理由是 。
(5)工业上通常用铜与浓硝酸反应制得光谱纯硝酸铜晶体(化学式为Cu(NO3)2·3H2O,摩尔质量为242g/mol)。已知:25℃、1.01×105 Pa时,在密闭容器发生反应:2NO2 N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
现用一定量的Cu与足量的浓高纯度硝酸反应,制得5.00 L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105 Pa),理论上生成光谱纯硝酸铜晶体的质量为________ g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
Cl2O与OF2互为等电子体,均能与水反应(与水解反应原理类似),Cl2O与水反应的化学方程式为:Cl2O+H2O=2HClO。下列说法正确的是
A.Cl2O与水的反应属于氧化还原反应
B.OF2、Cl2O分子的立体构型均为直线形
C.Cl2O分子中的共用电子对偏向Cl ,OF2分子中的共用电子对偏向F
D.OF2与水反应的化学方程式为:OF2 + H2O = 2HF + O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
已知反应:①SeO2+4KI+4HNO3 =Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:填空题
(本题共8分)炔烃与羰基化合物在强碱性条件下于乙醚中发生反应,可得到炔醇,反应原理为:

以下合成路线是某化工厂生产流程的一部分:

已知: 
请回答下列问题:
43.写出C中含氧官能团的名称 。
44.有关C的说法正确的是
a.不能使酸性高锰酸钾褪色 b.能和氢氧化钠溶液反应
c.能使溴的四氯化碳溶液褪色 d.能与乙酸发生酯化反应
45.经测定,E的分子结构与天然橡胶结构相同,写出D的名称(系统命名) 。
46.⑤的反应类型是 ;B的结构简式是 。
47.写出反应⑦的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
已知如下两个热化学反应方程式:

下列说法错误的是
A.反应①、②都属于加成反应
B.1,3—环己二烯比苯稳定
C.反应①、②的热效应说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:

请填写下列空白。
44.D分子中的官能团是__________;高分子M的结构简式是_____________。
45.写出A→B反应的化学方程式:_______________________。
46.B→C发生的反应类型有______________________。
47.A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。
①苯环上只有两个取代基;②能发生银镜反应;③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
48.以下对A具有的性质描述正确的是__
a.1molA可消耗2molNaOH
b.一定条件下1molA最多能与1mol氢气加成
c.能发生银镜反应
d.能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com