
下列物质中,属于电解质的是________,属于非电解质的是________;属于强电解质的是________,属于弱电解质的是________。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜
⑦冰醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 ⑪CO2
⑫NaHCO3
科目:高中化学 来源: 题型:
硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某水溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH 、Cl-、CO
、Cl-、CO 、SO
、SO 中的若干种离子。某同学取100 mL的溶液分成两等份进行如下实验:
中的若干种离子。某同学取100 mL的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02 mol的气体,无沉淀产生,同时得到溶液甲。
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02 g固体。
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65 g固体。
据此,该同学得到的结论正确的是( )
A.实验①中产生的气体为氨气,并可得原溶液中c(NH )=0.2 mol·L-1
)=0.2 mol·L-1
B.实验③中的白色沉淀中一定有BaSO4,无BaCO3
C.原溶液中一定有K+,且c(K+)=0.4 mol·L-1
D.若要判断原溶液中是否有Cl-,无需另外设计实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子组的评价及相关离子方程式均正确的是( )
| 选项 | 离子组 | 评价及离子方程式 |
| A | H+、Fe2+、NO | 不能大量共存于同一溶液中,因为发生反应:Fe2++2H+===Fe3++H2↑ |
| B | Na+、K+、HCO | 不能大量共存于同一溶液中,因为发生反应:HCO |
| C | Ca2+、NH | 能大量共存于同一溶液中 |
| D | Na+、NH | 能大量共存于同一溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO 、SO
、SO 、CO
、CO ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液显碱性的原因是________________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是_______________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
A.Cu溶于稀HNO3:Cu+2H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在______(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO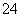 ===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D为原子序数小于18的四种元素:
①A原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布。推断A~D各为何种元素,并填空:
(1)A________;B________;C________;D________。
(2)各原子形成简单离子的电子排布式。
(3)四种元素离子半径的大小顺序为______________________________。
(4)用离子方程式表示D2B水溶液呈碱性的原因:___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com