
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断
C(g)+D(g)过程中的能量变化如图所示,由此可判断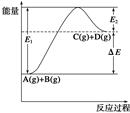
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
D
解析试题分析:A.由方程式可以看出该反应为可逆反应,当把1molA与1molB放入指定的密闭容器中时,由于可逆反应不能进行到底。即反应物不能完全转化为生成物,所以充分反应后,能量变化<ΔE。错误。B.加入催化剂后,由于反应途径发生改变,降低了反应的活化能,反应速率加快,但反应热ΔE不会发生变化。错误。C.由图像可知该反应为吸热反应。即反应物的总键能大于生成物的总键能。错误。 D.由图像可以看出该反应的正反应为吸热反应。当反应达到平衡时,若升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动。也就是向正反应方向移动,所以反应物A的转化率增大。正确。
考点:考查反应热与键能的关系及外界条件对化学平衡移动的影响的知识。


科目:高中化学 来源: 题型:单选题
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.△H<0,△S>0的化学反应一定能自发进行 |
C.已知热化学方程式2SO2(g)+O2(g)  2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中和热测定实验中,下列操作一定会降低实验准确性的是( )
| A.用滴定管取所用药品 |
| B.NaOH溶液在倒入小烧杯时,有少量溅出 |
| C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 |
| D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
炎热的夏季里,能喝上一口冰镇饮料是非常惬意的事情。目前,一种人称“摇摇冰”的即冷即用饮料已经上市。所谓“摇摇冰”,是指吸食前将饮料隔离层中的制冷物质和水混合摇动能使罐中饮料冷却。若该制冷物质可以在下列物质中选择,它应该是( )。
| A.氯化钠 | B.固体硝酸铵 | C.固体氧化钠 | D.固体氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某可逆反应过程能量变化如图所示,下列说法中正确的是 ( )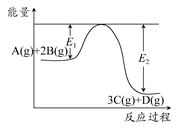
A.该反应热化学方程式为A(g)+2B(g)  3C(g)+D(g) ΔH>0 3C(g)+D(g) ΔH>0 |
| B.其他条件不变,升高温度,A的转化率增大 |
| C.其他条件不变,增大压强,释放热量减少,平衡常数K减小 |
| D.其他条件不变,加催化剂,反应速率增大,E1和E2均减小,ΔH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列过程都与热量变化有关,其中表述不正确的是 ( )
| A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列热化学方程式:
Na+(g)+Cl-(g)=NaCl(s) ΔH
Na(s)+ Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1
Na(s)=Na(g) ΔH2,Na(g)-e-=Na+(g) ΔH3 Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5的关系正确的是( )
| A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 |
| B.ΔH=ΔH1-ΔH2-ΔH3-ΔH4-ΔH5 |
| C.ΔH=ΔH1-ΔH2+ΔH3-ΔH4+ΔH5 |
| D.ΔH=ΔH2+ΔH3+ΔH4+ΔH5-ΔH1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com