
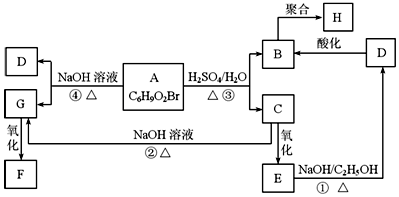
 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:
A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:分析 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4,由A与D相互转化及A能与氢氧化钠溶液反应,可知A为Al、D为Al2O3,结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3,据此解答.
解答 解:A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4,由A与D相互转化及A能与氢氧化钠溶液反应,可知A为Al、D为Al2O3,结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3,
(1)D为氧化铝,能做冶炼金属的原料、做耐火材料,故答案为:做冶炼金属的原料;做耐火材料;
(2)A是Al,铝箔在氧气中剧烈燃烧,放出大量的热和发出耀眼的白光,故答案为:剧烈燃烧,放出大量的热和发出耀眼的白光;
(3)该反应为铝热反应,发生置换反应,反应方程式为4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,故答案为:4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn;
(4)②离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
③离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题以Al及其化合物之间的转化为载体考查无机物推断,为高频考点,侧重考查学生分析推断能力,利用物质特殊性为突破口进行推断,注意铝和NaOH溶液反应中NaOH不是氧化剂,为易错点.


科目:高中化学 来源: 题型:解答题
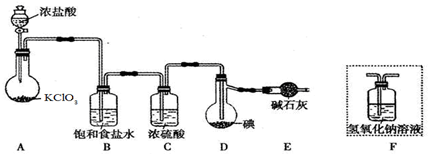
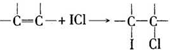
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
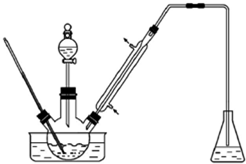 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com