
下列说法正确的是
A.原子的第一电离能越大,该元素的电负性就越大
B.原子的电子层数越多,原子半径越大
C.原子失去电子越多,说明其还原性越强
D.同一原子的能层越高,S电子云的半径越大
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
在汽油中添加适量酒精作为汽车燃料的技术已经逐步向全国推广。已知C8H18和C2H5OH燃烧的热化学方程式分别为:
2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-10900 kJ·mol-1
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol-1
假定汽油的成分为C8H18,则用添加酒精的汽油做汽车燃料时,不能达到的目的是( )
A.节省化石燃料
B.减少有害气体的排放
C.有利于转化过剩的粮食
D.提高每千克燃料燃烧放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:

依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)银电极为电池的________极,发生的电极反应为________;X电极上发生的电极反应为________。
(3)外电路中的电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的数据是破坏1 mol化学键所消耗的能量。
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
根据上述数据回答(1)~(4)题。
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HF B.HCl
C.HBr D.HI
(3)X2+H2===2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:________。
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一镁铝合金,根据某同学的操作,回答下列问题:
(1)将合金与过量NaOH溶液反应,所得溶液中不存在的离子是________。
A.Na+ B.Mg2+
C.OH- D.AlO
(2)将合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F====(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a. 配位键 b. 氢键 c. 金属键 d. 离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中 键与
键与 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。

a.稳定性 b.沸点 c .R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如右图 )顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中铋元素的数据见右图,下列说法正确的是
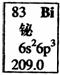 A.Bi元素的质量数是209
A.Bi元素的质量数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p亚层有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
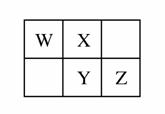
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,有一处于平衡状态的反应:
X(s)+3Y(g)2Z(g),为了使平衡向生成Z的方向移动,应选择条件是_______________________________________。
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com