
| A. | 质量 | B. | 分子数 | C. | 密度 | D. | 原子数 |
分析 标况下气体摩尔体积相同,根据n=$\frac{V}{{V}_{m}}$=$\frac{V}{22.4L/mol}$可知,容积相等的两个贮气瓶中盛有的气体的物质的量、分子数相等;由于二者含有的原子数不同,则含有的原子数不相等;气体的密度与气体的摩尔质量成正比,据此对各选项进行判断.
解答 解:标准状况下气体摩尔体积Vm相同,根据n=$\frac{V}{{V}_{m}}$=$\frac{V}{22.4L/mol}$可知,容积相等的两个贮气瓶中盛有的气体的物质的量、分子数相等,
A.根据m=nM可知,气体的物质的量相等,质量与摩尔质量成正比,由于二者的摩尔质量不同,则两瓶气体的质量不同,故A错误;
B.气体的物质的量相等,则两瓶气体具有相同的分子数,故B正确;
C.相同条件下气体的密度与摩尔质量成正比,氧气和甲烷的摩尔质量不同,则气体的密度不同,故C错误;
D.氧气和甲烷分子中含有的原子数不同,二者物质的量相等时含有的原子数一定不相等,故D错误;
故选B.
点评 本题考查了阿伏伽德罗定律及其推论的应用,题目难度中等,明确阿伏伽德罗定律的内容为解答关键,注意熟练掌握物质的量与摩尔质量等物理量之间的关系,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同位素,物理性质有差异而化学性质相似 | |
| B. | N2与O2的反应属于氮的固定 | |
| C. | 元素周期表中7个横行分别是7个周期,18个纵行分别是18个族 | |
| D. | 1mol金刚石比1mol石墨燃烧放出热量多,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 32 g/mol | C. | 34 g | D. | 34 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
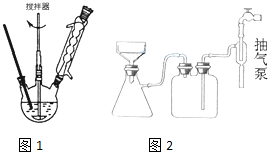 羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:

| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
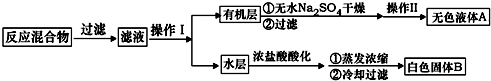
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
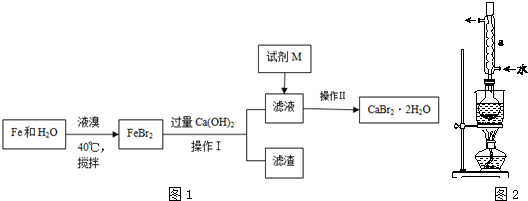
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com