
25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:选择题
下列物质中属于电解质的是
①氢氧化钠 ②硫酸钡 ③铜 ④酒精 ⑤氯水
A.①② B.①②⑤ C.③④ D.①⑤
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
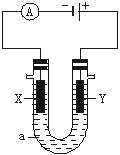
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_______________。在X极附近观察到的现象是________________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是___________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式为________________。
②Y电极的材料是__________,电极反应式为_______________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁?过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
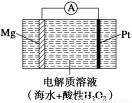
A.电池的负极反应为Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
等物质的量浓度的下列五种溶液:①CH3COOH②(NH4)2CO3③NaHSO4④NaHCO3⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是
A.⑤③①④② B.⑤③①②④
C.②④③①⑤ D.②④①③⑤
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考B层化学试卷(解析版) 题型:填空题
(7分)以乙烯为原料合成化合物C的流程如下所示:
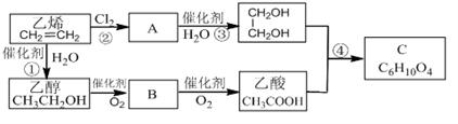
(1) 乙醇和乙酸中所含官能团的名称分别为: 和 。
(2) B物质的结构简式为 。
(3) ① 、④的反应类型分别为 反应和 反应。
(4) 反应②和④的化学方程式分别为:
② ;② 。
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考B层化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
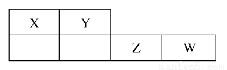
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:填空题
(10分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
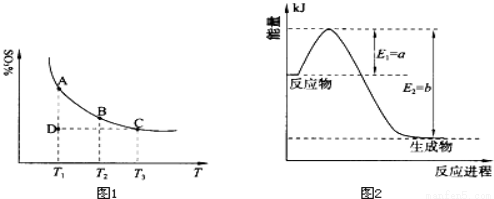
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高一9月月考化学试卷(解析版) 题型:选择题
对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com