
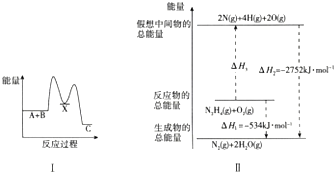
分析 (1)根据图象结合反应物总能量大于生成物总能量时,该反应为放热反应即△H<0,反应物总能量小于生成物总能量时,该反应为吸热反应即△H>0判断;
(2)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),即断裂1molN-N键、4molN-H键和1molO=O键共吸收2752kJ-534kJ=2218kJ,据此计算.
解答 解:(1)由图象得出反应A+B→C即反应物总能量大于生成物总能量,则该反应为放热反应,所以△H<0,反应A+B→X即反应物总能量小于生成物总能量,则该反应为吸热反应,所以△H1>0,X→C即反应物总能量大于生成物总能量,则该反应为放热反应,所以△H2<0;顾答案为:<;>;<;
(2)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),即断裂1molN-N键、4molN-H键和1molO=O键共吸收2752kJ-534kJ=2218kJ,设断裂1molN-H键所需的能量为xkJ,则有154+4x+500=2218,解得x=391,
故答案为:391kJ.
点评 本题考查学生根据反应物和生成物的能量大小判断吸放热以及化学键的断裂和生成与反应的吸放热之间的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.125mol | C. | 0.175mol | D. | 0.025mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,容器内压强增大,平衡向右移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | 没有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com