
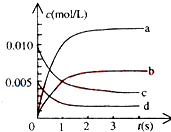
 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 ①从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,是可逆反应,根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;
根据△v=$\frac{\frac{△n}{V}}{△t}$计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
②化学平衡的标志是正逆反应速率相同,各组分含量保持不变.
解答 解:①从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,所以反应为可逆反应,根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=$\frac{\frac{0.020mol-0.008mol}{2L}}{2min}$=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L•s),
故答案为:b,0.0015mol/(L•s);
②a.反应速率之比等于化学方程式计量数之比,v(NO2)=2v(O2)为正反应速率之比,不能说明正逆反应速率相同,无法判断正逆反应速率是否相等,故a错误;
b.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故b正确;
c.反应速率之比等于化学方程式计量数之比为正反应速率之比,v逆(NO)=2v正(O2)时,一氧化氮正逆反应速率相同,说明反应达到平衡状态,故c正确;
d.恒容容器,反应物生成物都是气体质量不变,体积不变,所以密度始终不变,不能说明反应达到平衡状态,故d错误;
故选bc,
故答案为:bc.
点评 本题考查了可逆反应的判断、反应速率的计算、影响反应速率及化学平衡状态的判断,注意压强、密度不变时平衡状态的判断为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaCl溶液中含NA个Cl- | |
| B. | 标准状况下,11.2LCCl4中含有0.5NA个分子 | |
| C. | 同温同压下,2NA个C2H4(g)与NA个C4H8(g)的密度不相等 | |
| D. | 64gSO2与足量的O2充分反应后得到NA个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
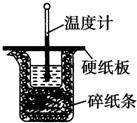 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛浸泡的海产品 | |
| B. | 霉变的大米、花生 | |
| C. | 用亚硝酸钠(NaNO2)代替食盐烹调的食品 | |
| D. | 食盐腌制的咸鸭蛋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性:I2>Br2>Cl2 | B. | 热稳定性:PH3>H2S>HCl | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com