
分析 (1)足球烯为含有60个C原子的烃;氧化铜的化学式中含有1个铜离子和1个氧离子;
(2)亚硫酸钠与氧气反应生成硫酸钠,据此写出反应的化学方程式.
解答 解:(1)①足球烯分子中含有60个C原子,其分子式为:C60,
故答案为:C60;
②氧化铜为离子化合物,其化学式为:CuO,
故答案为:CuO;
(2)亚硫酸钠与氧气反应生成硫酸钠,反应的化学方程式为:2Na2SO3+O2=2Na2SO4,
故答案为:2Na2SO3+O2=2Na2SO4.
点评 本题考查了化学方程式书写、常见物质组成、名称与化学式的关系,题目难度不大,明确常见物质的组成与化学式的关系为解答关键,注意掌握化学方程式的书写原则,试题培养了学生的灵活应用能力.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | Na2O2与CO2反应生成11.2LO2(标准状况),反应中转移的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含的氧原子数目为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠质软,可用小刀切割 | |
| B. | 钠在空气中燃烧生成白色的过氧化钠 | |
| C. | 热的纯碱溶液可以除去铜片表面的油污 | |
| D. | 碳酸氢钠是焙制糕点所用发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了区别一般的化学方程式 | B. | 物质的状态与反应热有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92KJ/mol | |
| B. | a曲线是加人催化剂时的能量变化曲线 | |
| C. | 加人催化剂,该化学反应的放热减少 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中n(Fe2+)与n(Fe3+)之比为6:1 | |
| B. | 氧化产物与还原产物的物质的量之比为2:5 | |
| C. | 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变 | |
| D. | 往溶液中滴加无色KSCN溶液,不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
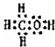 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com