
【题目】向100mL FeI2溶液中逐渐通入Cl2(溶液体积变化忽略不计),生成I2、Fe3+的物质的量随通入Cl2的物质的量的变化如图所示,下列说法错误的是( )
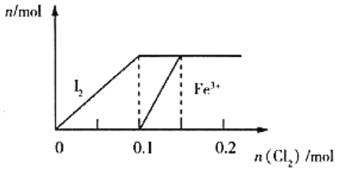
A.还原性强弱:Fe2+<I-
B.n(Cl2)=0.05mol时,溶液中I-的物质的量浓度为0.1mol·L-1
C.若n(Cl2):n(FeI2)=6:5,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
D.n(Cl2)=0.12mol时,溶液中的离子主要有Fe3+、Cl-
【答案】D
【解析】
A.由题图知,向FeI2溶液中逐渐通入Cl2,依次生成碘、铁离子,则还原性Fe2+<I-,故A正确;
B. 由题图知,通入0.1mol氯气时,碘离子完全被氧化,则生成n(I2)=0.1mol,原溶液中n(I-)=0.2mol,当通入0.05mol氯气时,被氧化的n(I-)=0.1mol,剩余n(I-)=0.1mol,则c(I-)=0.1mol÷0.1L=1mol/L,故B正确;
C. 若n(Cl2):n(FeI2)=6:5,假设氯气为6mol,FeI2为5mol,5molCl2先把10molI-氧化完,剩余的1mol氯气再与2molFe2+反应,离子方程式为:2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-,故C正确;
D. 由题图知,当氯气为0.12mol时,碘离子反应完,Fe2+还未反应完,故D错误;
故答案选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 10gNH3含有4NA个电子
B. 0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C. 标准状况下,22.4 L H2O中分子数为NA 个
D. 1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
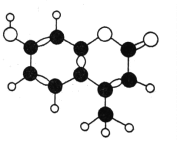
①分子式为C10H9O3 ②不能溶于水 ③1mol该物质最多能与4molH2加成 ④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2mol NaOH的溶液反应
A. ①②③B. ③④⑤C. ②③④D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法不正确的是( )

A.B为电源的正极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.电子移动的方向是B→右侧惰性电极,左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
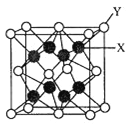
(1)E在同期表中的位置是_______,其基态原子的简化电子排布式为____________。
(2)CB![]() 的立体构型是______。
的立体构型是______。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为____(填离子符号);D2C的熔点比CaF2熔点__________________(填“高”、“低”或“无法比较”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
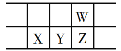
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知在120℃、101 kPa下,1 gH2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D. 25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种用途广泛的香料,可用烃A与有机物E为原料,按照如下流程进行合成。已知A在标准状况下的密度为1.25 g·L-1。

回答下列问题:
(1)有机物F中含有的官能团名称为____。
(2)A生成B的反应类型为________。
(3)写出流程中B生成C的化学方程式_______。
(4)下列说法正确的是____。
A 流程图中有机物B转化为C,Cu参与了化学反应,但反应前后的质量保持不变
B 有机物C不可能使溴水褪色
C 有机物D、E生成F的反应为酯化反应,本质上是取代反应
D 合成过程中原子的理论利用率为100%的反应只有一个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com