

| A. | Z、M的单质均不能与冷水反应 | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | 气态氢化物的热稳定性:Y<N<R | |
| D. | 简单离子半径:M<Z<Y<X |
分析 同一周期元素,原子半径随着原子序数增大而减小,电子层数越多原子半径越大,根据图中元素原子半径与原子序数关系知,Z、M、N、R位于第三周期,分别是Na、Al、Si、Cl元素;X、Y位于第二周期,分别是O、F元素,据此结合元素周期律知识解答.
解答 解:同一周期元素,原子半径随着原子序数增大而减小,电子层数越多原子半径越大,根据图中元素原子半径与原子序数关系知,Z、M、N、R位于第三周期,分别是Na、Al、Si、Cl元素;X、Y位于第二周期,分别是O、F元素,
A.Z、M的单质分别为Na、Mg元素,Na活泼性较强,能够与冷水反应,故A错误;
B.R、N分别为Cl、Si元素,非金属性Cl>Si,则最高价氧化物对应水合物的酸性:R>N,故B错误;
C.非金属性越强,气态氢化物的稳定性越强,非金属性Y(F)>R(Cl)>N(Si),则气态氢化物的热稳定性:N<R<Y,故C错误;
D.Z、M、X、Y分别为Na、Al、O、F,四种离子都含有2个电子层,离子的核电荷数越大,离子半径越小,则离子半径大小为:M<Z<Y<X,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,根据元素原子半径与原子序数的关系推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.8g正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA | |
| B. | 1mol的CO2和水蒸气的混合气体与过量Na2O2充分反应转移的电子数为2NA | |
| C. | 将0.2molNH3充入密闭容器中在一定条件下加热分解,生成N2的分子数为0.1NA | |
| D. | 相同温度下50mL0.1mol•L-1CH3COOH溶液和10mL0.5mol•L-1CH3COOH溶液中所含CH3COOH分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 | |
| B. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| C. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| D. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、W、Q、X、Y原子半径依次减小 | |
| B. | W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中 | |
| C. | Y与Q形成化合物在常温下一定为气态 | |
| D. | Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
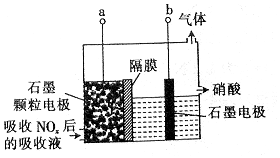
| A. | 吸收NOx的过程涉及氧化还原反应 | |
| B. | 石墨电极为颗粒状,可增大接触面积,提高电解效率 | |
| C. | 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值) | |
| D. | a极的电极反应式为HNO2-2e-+H2O═3H++NO3- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:实验题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
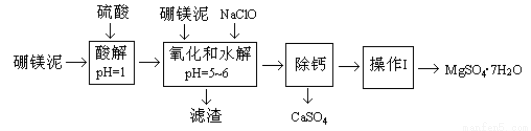
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com