
检验铵盐的一般方法是将待检物质取出少量放入试管中,然后
A.直接加热,用湿润的红色石蕊试纸在试管口处试验
B.加水溶解,向溶液中滴加紫色试蕊溶液
C.加入氢氧化钠溶液后,加热,将湿润的红色石蕊试纸放在试管口
D.加入强碱溶液加热后再滴入酚酞溶液
科目:高中化学 来源: 题型:
| A、加水溶解后,再滴入酚酞试液 | B、加强碱溶液加热后,用湿润红色石蕊试纸在试管口检验 | C、加入强酸溶液加热后,再滴入酚酞试液 | D、加入强碱溶液加热后,再滴入酚酞试液 |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第19~26期 总第175~182期 人教课标版 题型:058
实验室通过加热氯化铵与氢氧化钙的混合物制备氨
(如图所示):2NH4Cl+Ca(OH)2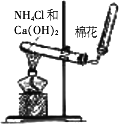
查看答案和解析>>
科目:高中化学 来源:2012届浙江省金华一中高三上学期期中考试化学试卷 题型:实验题
(14分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO 4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
(已知: (NH4)2SO4+FeSO4+ 6H2O (NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
(NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
(1)步骤1中Na2CO3的主要作用是 。
(2)步骤2中铁屑过量的目的是(用离子方程式表示): 。步骤2中溶液趁热过滤的原因是 。
(3)步骤3中,加入(NH4)2SO4固体后,应加热到溶液表 面出现晶膜时,停止加热。为什么不能蒸干? 。需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥
面出现晶膜时,停止加热。为什么不能蒸干? 。需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥
的晶体。步骤3中制得的晶体要用无水乙醇洗涤的目的是 。
(4)摩尔盐产品中离子的检验:
甲同学提出可以用湿润的 试纸、稀盐酸和 溶液检验出这三种离子。
乙同学提出检验产品中的Fe2+,可以用KSCN溶液和另一种试剂 来检验,试简述乙同学操作和现象: 。
(5)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00 mL。
①本实验的指示剂 。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com