
【题目】密度为0.911g/cm3的氨水,溶液中溶质的质量分数为25%,该氨水用等体积的水稀释后,所得溶液质量分数为( )
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s)+ O2(g)![]() CO2(g) ΔH=-437.3 kJmol-1
CO2(g) ΔH=-437.3 kJmol-1
H2(g)+ ![]() O2(g)
O2(g)![]() H2O(g) ΔH=-285.8 kJmol-1
H2O(g) ΔH=-285.8 kJmol-1
CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJmol-1
CO2(g) ΔH=-283.0 kJmol-1
则煤的气化主要反应的热化学方程式是
C(s)+ H2O(g)![]() CO(g)+ H2(g) ΔH= kJmol-1。
CO(g)+ H2(g) ΔH= kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强,化学反应速率增加
B.降低压强,化学反应速率降低
C.改变压强,化学反应速率可能不变
D.改变压强引起了速率改变,平衡就会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A.由图甲可知,升高温度醋酸钠的水解程度增大
B.由图乙可知,a点Kw的数值比b点Kw的数值大
C.由图丙可知,反应A(g)+B(g) ![]() 2C(g)是吸热反位
2C(g)是吸热反位
D.由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
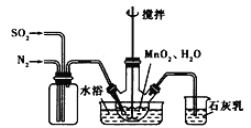
(1)制备MnSO4溶液:在烧瓶中(装置见上图)加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤。
①写出反应方程式:MnO2+ H2SO3=_________________;
石灰乳参与反应的化学方程式为___________________。
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)________________、___________________。

③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异,其中Mn2+对O2与H2SO3反应所起的作用是_________________。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O 、Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入_________________,并控制溶液pH_______7.7;
②_______________________;
③_______________________;
④_______________________;
⑤低于100℃干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的![]() LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A.![]() mo1·L-1 B.
mo1·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0. 2molNH3。下列对这四种气体相关量的比较不正确的是
A. 体积:②>③>①>④ B. 密度:②>③>④>①
C. 质量:②>③>①>④ D. 氢原子数:①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10mL 0.05mol/L的某金属硫酸盐M2(SO4)x溶液中,滴加15mL 0.10mol/L的BaCl2溶液,恰好完全反应生成硫酸钡沉淀,该金属的化合价为
A. +1 B. +2 C. +3 D. 不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com