
【题目】下列有关实验原理、装置、操作或结论的描述,错误的是

A. 图1所示装置可实现甲烷与氯气在光照条件下的取代反应
B. 图2所示装置可分离CH3COONa溶液和CH3COOC2H5的混合液
C. 图3是原电池装置,有明显的电流
D. 图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。

⑴铜片上的现象是__________________________ ,电极反应为________________ ,_____________(填“锌片”或“铜片”)只起传导电子的作用。
⑵电子由_____________经导线流向_____________ ,_____________为负极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
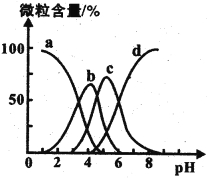
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 2NO2(g)![]() N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①④⑤B. ②⑤C. ①③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热氯酸钾的方法制取少量氧气。
(1)请写出反应的化学方程式。_____
(2)现欲制取1.12L(标准状况)氧气,理论上需要消耗氯酸钾多少克?生成氯化钾物质的量多少?______、______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________;
b.W中Li+与孤对电子之间的作用属于___________(选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
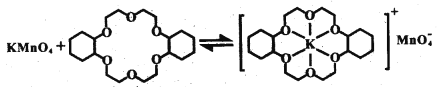
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________;
②甲烷分子的配位数为___________;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________。
④甲烷晶体的密度为___________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学键是物质中原子间强烈的相互作用
B. 化学键是使原子或离子相结合的作用力
C. 一切物质中都存在化学键
D. ⅠA族元素原子与ⅦA族元素原子之间都形成离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com