
����Ŀ��Ϊ����֤SO2�����ʣ�ijͬѧ������Һ���������ͼ1��ʵ�飺 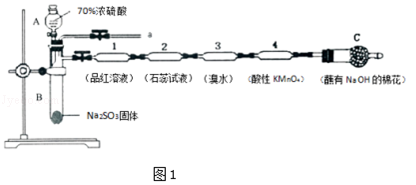
�ش��������⣺
��1������A�������� ��
��2��װ��l�е���������װ��3��֤��SO2�����ԣ�
��3������˵����ȷ���� ��
A.װ��2����ɫʯ����Һ����ԭ����SO2+H2O=H2SO3 �� H2SO3������
B.ʵ���������Һ��1������Һ����ɫ
C.ʵ���������a������װ���м�ˮ��������ϳ����ٲ�װ�ã���ֹ������SO2�ж�������Ⱦ����
D.��a���ܴ��������ſ������ռ�SO2
��4��װ��4�����Ը��������ɫ�����ⶨ��Ӧ����Һ�к���Mn2+��SO42�� �� ��д���÷�Ӧ�����ӷ���ʽ ��
��5����ѧ����������ͼ����������װ�ɵ�װ�ã���ͼ2��֤��S��C��Si�ǽ�����ǿ�����ɹ�ѡ����Լ��У����ᡢ�����ᡢ���ᡢľ̿����������Һ�� 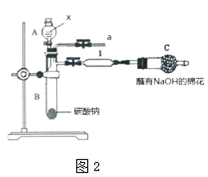
��װ��A���Լ�X����װ��1�з�Ӧ�Ļ�ѧ����ʽ�� ��
��ʵ����ۣ���Ϊ����ǿ�����������ѧʽ�����ʷǽ�������S��C��Si��
���𰸡�
��1����Һ©��
��2����ɫ����ԭ
��3��AC
��4��2MnO4��+5SO2+2H2O=2Mn2++5SO42��+4H+
��5�����CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3��H2SO4��H2CO3��H2SiO3
���������⣺��1������A�������Ƿ�Һ©�������Դ��ǣ���Һ©������2�����������������Ư���ԣ�װ��l�е�������Ʒ����Һ��ɫ������������л�ԭ�ԣ�ͨ��װ��3����ˮ��ɫ��֤��SO2���л�ԭ�ԣ� ���Դ��ǣ���ɫ����ԭ����3��A��������������ˮ��ˮ��ӦSO2+H2O=H2SO3 �� ����������ʯ����ɫ����A��ȷ��B����������Ư���Ծ��п����ԣ����Ȼָ���ɫ��ʵ���������Һ��1������Һ���ɫ����B����C��ʵ���������a������װ���м�ˮ����װ��������ϳ�����ֹ������SO2�ж�������Ⱦ��������C��ȷ��D��SO2����ȿ����أ���a���ܴ��������ſ������ռ�SO2 �� ��D�������Դ��ǣ�AC����4��װ��4�����Ը��������ɫ�����ⶨ��Ӧ����Һ�к���Mn2+��SO42�� �� �Ƕ������������������ᣬ��Ӧ�����ӷ���ʽΪ��2MnO4��+5SO2+2H2O=2Mn2++5SO42��+4H+ �� ���Դ��ǣ�2MnO4��+5SO2+2H2O=2Mn2++5SO42��+4H+����5���ٷ���ǿ����ȡ����ķ�Ӧ��������Ϊ���̼����ᣬ����ۺ���������Կ�֪�ǽ�����ΪS��C��Si��װ��A���Լ�X�����ᣬװ��1�з�Ӧ�Ļ�ѧ����ʽ�ǣ�CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3 �� ���Դ��ǣ���� CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3����װ����A���������B��̼���Ʒ�����Ӧ���ɶ�����̼��������̼ͨ��װ��1�й�������Һ����Ӧ�ɰ�ɫ�������ᣬǿ���Ʊ����ᣬ����ǿ����H2SO4��H2CO3��H2SiO3 �� ����ۺ���������Կ�֪�ǽ�����ΪS��C��Si�����Դ��ǣ�H2SO4��H2CO3��H2SiO3 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ����Ӽ��ֺ����ۼ����� ( )
A. Na2O B. NaOH C. NH3 D. CaBr2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȱ����Ԫ�ص���������ֲ������Щũ����������������Ӱ�죨 ��
��С�� ������ �۸��� �ܸ��� ������ �ƶ� �ƻ���
A. �٢ڢۢܢݢޢ� B. �ܢݢ� C. �ܢݢޢ� D. �ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�������Ͳ�������ʱ�ͻ�鴤��������ѧ֪ʶ��������ƽʱҪ��(����)
A. ����ˮ�����߲� B. ��Ƭ��ά����D
C. ������Ƥ�ͺ��ܲ� D. �����ʺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʢ�ĺ�ϸ����Ԫ�غ����Ĵ�С��ϵ��
A. Fe��O��C��H��N B. C��O��H��N��Fe
C. O��C��H��N��Fe D. ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ����Al2O3��Fe2O3��FeO��SiO2���������Ʊ���ˮ������KAl��SO4��212H2O�Ͳ�Ѫ��FeSO47H2O�������������£����ֲ����Ͳ�����ȥ���� 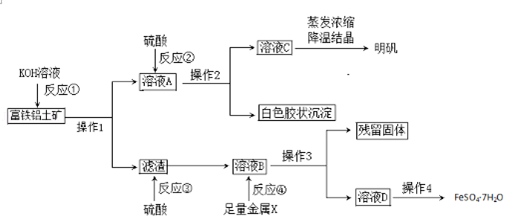
��1������1�������� ��
��2����Ӧ�٢ڢۢ�����������ԭ��Ӧ��������д��ţ���
��3���ۺϿ��ǣ�����X���ѡ����Լ��� �� д���÷�Ӧ���ӷ�����ʽ ��
��4����Ӧ�ٵ����ӷ���ʽ���� ��
��5����ҺD�к��еĽ����������� �� ���鷽���� ��
��6���ú���Ԫ��27%��������ʯ10�֣�ͨ����������������������֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ���������н�������ܳ��ֵ��ǣ� ��
A. ��ͭ���� B. ������ͭ C. ����ͭ���� D. ����ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ����Ӧ�����������仯��ͼ��ʾ������˵����ȷ����(����)

A. �÷�ӦΪ���ȷ�Ӧ
B. ����Ӧ�ﵽƽ��ʱ�������¶ȣ�A��ת���ʼ�С
C. �����¶�ƽ�ⳣ��K����ѹǿ����ƽ��������Ӧ�����ƶ�
D. �����������Ӧ��������Ӧ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�������ų��������ɼ����к��ȡ��ش��������⣺
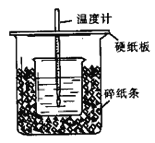
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________________��
��2���ձ���������ֽ��������__________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ ___________(��ƫ��ƫС����Ӱ�족)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� ________( ����ࡱ�����١������䡱)�������к���_______(����ȡ�����ȡ�)
��5������ͬŨ�Ⱥ�����İ�ˮ��NH3��H2O������NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��_____________����ƫ����ƫС��������Ӱ�족����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com