
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
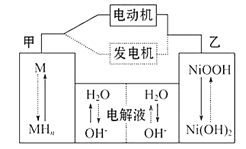
A. 充电时,阴极附近pH降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为: NiOOH+H2O+e- = Ni(OH)2+OH-
D. 电极总反应式为:M+Ni(OH)2 = MH+NiOOH
【答案】A
【解析】分析:放电过程为原电池,NiOOH转变为Ni(OH)2,镍的化合价从+3价降到+2价,则乙为正极,电极反应式为NiOOH+H2O+e﹣═Ni(OH)2+OH﹣,甲为负极,MH中H由0价升高到+1价,氢失电子发生氧化反应与溶液中的氢氧根离子结合成水,电极反应为MH﹣e﹣+OH﹣═M+H2O;充电是放电的逆过程,此时甲为阴极发生还原反应,乙为阳极发生氧化反应,据此解答。
详解:A项,充电时,甲电极得电子被还原,是阴极,由图可知,阴极附近H2O变为OH-,pH增大,故A项错误;B项,电动机工作时为放电过程,甲为原电池的负极,阴离子向负极移动,故B项正确;C项,放电时,正极的NiOOH得电子被还原,化合价降低,电极反应式为NiOOH+H2O+e- = Ni(OH)2+OH-,故C项正确;D项,镍氢电池充电过程中,M转化为MH,Ni(OH)2转化为NiOOH,放电过程与充电过程相反,因此电极总反应式为M+Ni(OH)2 = MH+NiOOH,故D项正确。综上所述,本题正确答案为A。


科目:高中化学 来源: 题型:
【题目】将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A. Fe2+、Cl-、SO42-、Na+B. NH4+、Al3+、NO3-、Cl-
C. Ca2+、K+、Cl-、HCO3-D. K+、Na+、SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g) +CO2 (g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______。
(3)500℃时测得反应在某时刻,H2(g)、CO2(g)、CH3OH(g)H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时V正____V逆(填“>”“=”“<”)。
(4)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示,若开始加入2mol/LH2和1mol./LCO,则B点时化学平衡常数为___________。

(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______,乙中CO2的转化率____甲。(填“大 于”、“等 于”或“小于”)
起始浓度 | 甲 | 乙 |
c(H2)/mol/L | 0.10 | 0.20 |
c(CO2 )/mol/L 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中各装置的叙述不正确的是

A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AJ几种有机物的分子球棍模型或结构简式如图所示,据此回答下列问题:

(1)不能够发生加成反应的烃有__________种,属于芳香族化合物的有_____种。
(2)与E互为同系物的是__________,与G互为同分异构体的是__________。(填字母)
(3)在催化剂作用下,D能与水反应生成乙醛,写出该反应的化学方程式:___________。
(4)上述有机物中有一种能与NaOH溶液反应,请写出该反应的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com