
【题目】如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。已知2NO+O2==2NO2,打开活塞,使NO与O2充分反应,则下列说法正确的是
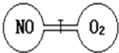
A. 开始时左右两室分子数相同B. 反应开始后NO室压强增大
C. 最终容器内密度与原来相同D. 最终容器内仍然有NO剩余
【答案】C
【解析】
A. 由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,再结合n = ![]() 来判断气体的物质的量关系,据此判断;
来判断气体的物质的量关系,据此判断;
B. 发生2NO+O2=2NO2,反应后总的物质的量减少,故反应后NO室的气体物质的量要减小;
C. 气体的总质量为原来一氧化氮与氧气质量之和,为NO质量的2倍,体积为左右两室的体积之和,为左室的2倍,故密度不变;
D. NO、O2的质量相等,二者物质的量之比为32:30=16:15,发生2NO+O2=2NO2,NO 少量,无剩余。
A. 由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,而NO和O2的摩尔质量不相等,故其物质的量不相等,开始时左右两室分子数不相同,故A项错误;
B. 发生2NO+O2=2NO2,反应后总的物质的量减少,平均充满左右两室,故反应后NO室的气体物质的量要减小,故压强减小,故B项错误;
C. 反应后气体的总质量为原来一氧化氮与氧气质量之和,为NO质量的2倍,体积为左右两室的体积之和,为左室的2倍,故密度不变,即最终容器内密度与原来相同,故C项正确;
D. NO、O2的质量相等,根据n = ![]() 得出,二者物质的量之比与摩尔质量成反比,即物质的量之比为32:30=16:15,发生的反应为2NO+O2 = 2NO2,可以看出参加反应的NO少量,无剩余,故D项错误;
得出,二者物质的量之比与摩尔质量成反比,即物质的量之比为32:30=16:15,发生的反应为2NO+O2 = 2NO2,可以看出参加反应的NO少量,无剩余,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列有关分散系的叙述中不正确的是( )
A.胶体分散质粒子较大,不能透过滤纸
B.分散系根据分散质粒子大小分为溶液、胶体和浊液三类
C.利用丁达尔效应可以区分溶液和胶体
D.将纳米材料![]() 微粒直径是1nm-100nm)分散到液体分散剂中的分散系属于胶体
微粒直径是1nm-100nm)分散到液体分散剂中的分散系属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A. +412 kJ·mol-1B. -412 kJ·mol-1C. +236 kJ·mol-1D. -236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
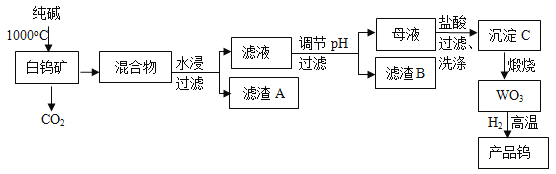
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
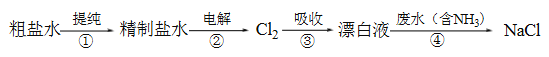
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号_________;
②若A微粒的中子数为10,写出表示A微粒的组成符号________;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________;
②工业上制备氯气____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________(用元素符号表示);
(2)X与水反应的化学方程式是______________;
(3)X中一种元素对应的单质,可与石灰乳反应得到漂白粉,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
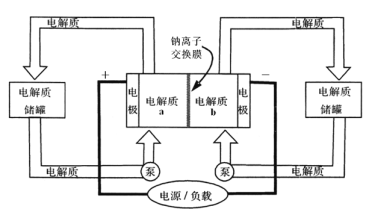
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)新制氯水中含有的微粒:H2O、HClO、Cl2、H+、Cl-、ClO-、___。
(2)判断:可以用pH试纸测定新制氯水的pH。___(打“√”或“×”)
(3)久置氯水与碳酸氢钠溶液反应的化学方程式___。
(4)写出铁在氯气中燃烧的化学方程式:___。
(5)写出电解饱和食盐水的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com