
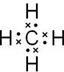
 ;
; ;
;

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、含有羟基的有机物称为醇 |
| B、能发生银镜反应的有机物都是醛 |
| C、苯酚俗称石炭酸,酸性比碳酸强 |
| D、酯类在碱性条件下的水解程度大于酸性条件下的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
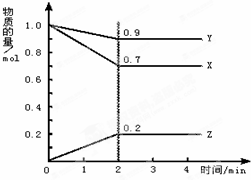 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
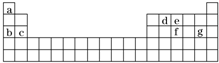
查看答案和解析>>
科目:高中化学 来源: 题型:
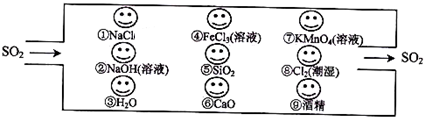
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①②④ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(4)(5) |
| B、(2)(5)(6) |
| C、(1)(4) |
| D、(2)(3)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com