
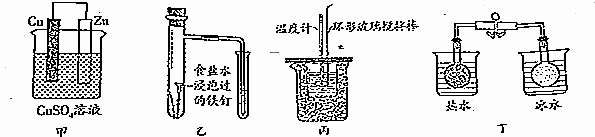
| A. | 图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性 | |
| B. | 图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图丙所示的实验:根据温度计读数的变化用浓硫酸和Na0H反应测定中和热 | |
| D. | 图丁所示的实验:根据两烧瓶中气体颜色的变化判断2N02(g)?N20(g)是吸热反应 |
分析 A.Cu、Zn原电池中,活泼金属为负极;
B.在中性溶液中发生吸氧腐蚀;
C.中和热测定应选稀的强酸;
D.热水中颜色深,则逆反应为吸热反应.
解答 解:A.Cu、Zn原电池中,活泼金属为负极,则根据检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性,故A正确;
B.析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少,用食盐水浸泡应发生吸氧腐蚀,故B错误;
C.中和热测定应选稀的强酸,则不能利用浓硫酸测定中和热,故C错误;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误;
故选A.
点评 本题考查较综合,为高考常见题型,侧重于学生的分析、实验能力的考查,涉及原电池和电解原理、中和热测定、温度对化学平衡的影响等,注意把握实验的严密性和可行性的评价,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ③⑤ | C. | ④⑥⑦ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 8种 | C. | 6种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com