
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.44g CO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L四氯化碳含有的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铍的最高价氧化物的水化物可能具有两性 | |
| B. | 砹单质是有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的固体 | |
| C. | 硫酸锶难溶于水,但易溶于盐酸 | |
| D. | 砷的最高价氧化物的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分反应后放出热量为Q | |
| B. | 增大压强,平衡右移,Q值变大 | |
| C. | 若生成1molSO3(s),放出热量大于$\frac{Q}{2}$ | |
| D. | 使用催化剂,改变反应途径,Q值也随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:
1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
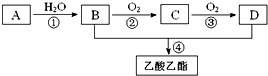
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com