
【题目】日常生活中食用的白糖、冰糖和红糖的主要成分是( )
A.淀粉
B.葡萄糖
C.蔗糖
D.果糖
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。
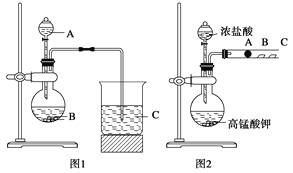
(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)____;
①稀硫酸溶液; ②浓盐酸; ③碳酸钠粉末;④Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式为__________________________________________;
(2)甲同学所做实验图1烧杯中现象为____________________________________;
(3)乙同学所做实验图2中B处的现象为__________________________________;
(4)写出图2中A处发生反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是( )
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.用100 mL量筒量取5.20 mL盐酸
C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体
D.过量的铁丝在氯气中点燃,可制取氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛。相关数据如表:
CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛。相关数据如表:
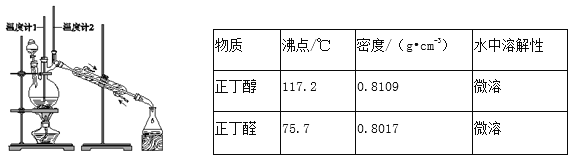
下列说法中,不正确的是
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液 逐滴加入正丁醇中
B. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性.I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是______.
②II中发生了分解反应,反应的化学方程式是______.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:

将实验 III、IV作对比,得出的结论是______;将 i、ii作对比,得出的结论是______.
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是______.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸______(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验I、II、III证明混合气体中含有Cl2,III的操作是______.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、______有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成月季和孔雀的主要元素有( )
A. C、H、O、N、P、Fe
B. C、H、O、S、N、P
C. H、O、K、S、P、Mg
D. N、P、K、Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)按要求写出下列反应的化学方程式:
①由饱和FeCl3溶液制备Fe(OH)3胶体_______________________________。
②氢氟酸腐蚀玻璃____________________________________。
(2)按要求写出下列反应的离子方程式:
①制漂白粉(有效成分为次氯酸钙)____________________________________。
②用硫氰化钾溶液检验溶液中含有Fe3+____________________________________。
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至溶液恰呈中性____________________________________;
Ⅱ.已知还原性是I->Fe2+>Br-,1L某溶液中含有FeI2和FeBr2两种溶质,分析知其中Fe2+、I-、Br-的物质的量比为1:1:1。取出1/10体积该混合溶液向其中通入氯气,发现吸收3.36L(标况下)的氯气后溶液中的溶质离子刚好完全被氧化得到I2、Br2、Fe3+。请回答:
①试写出此反应过程中第二步反应的离子方程式__________。
②求原混合溶液中各溶质的物质的量浓度______________。
③当溶液中Br-有一半被氧化时,通入的氯气在标况下所占体积是________升,此时溶液中溶质的物质的量浓度约为(不考虑溴和碘单质的溶解)________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com