
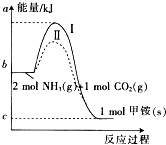
 ��������泥�NH2COONH4����Ƽ�泥���CO2��NH3�����ص��м�������CO2��Ӧ���ɼ�淋������仯��ͼ��ʾ��
��������泥�NH2COONH4����Ƽ�泥���CO2��NH3�����ص��м�������CO2��Ӧ���ɼ�淋������仯��ͼ��ʾ��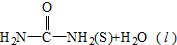 ��H=+dkJ•mol-1������CO2��g����NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪCO2��g��+2NH3��g��=
��H=+dkJ•mol-1������CO2��g����NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪCO2��g��+2NH3��g��=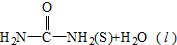 ����H=��-b+c+d��KJ/mol��
����H=��-b+c+d��KJ/mol�� ���� ��1����Ӧ������������������������Ϊ���ȷ�Ӧ����Ӧ������������������������Ϊ���ȷ�Ӧ��
��2������ͼ�����ݿ�֪��2mol������1mol������̼�������ɰ�������粒���ų�������b-c��KJ���ݴ���д�Ȼ�ѧ����ʽ��
��3��ʹ�ô����ܹ���ͷ�Ӧ�Ļ�ܣ�
��4��CO2��g��+2NH3��g��=H2NCOONH4��s����H=-��b-c��KJ/mol��
NH2COONH4��s��$\frac{\underline{\;\;��\;\;}}{\;}$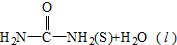 ��H=+dkJ•mol-1��
��H=+dkJ•mol-1��
���ݸ�˹���ɢ�+�ڵ�CO2��g��+2NH3��g��=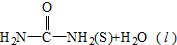 ���ݴ˼��㷴Ӧ�ȣ�
���ݴ˼��㷴Ӧ�ȣ�
��� �⣺��1������ͼ����Ϣ��֪����Ӧ�����������������������������Ը÷�ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��2������ͼ�����ݿ�֪��2mol������1mol������̼�������ɰ�������粒���ų�������b-c��KJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��CO2��g��+2NH3��g��=H2NCOONH4��s����H=-��b-c��KJ/mol��
�ʴ�Ϊ��CO2��g��+2NH3��g��=H2NCOONH4��s����H=-��b-c��KJ/mol��
��3��ʹ�ô����ܹ���ͷ�Ӧ�Ļ�ܣ�����ͼ�����ݿ�֪��IIʹ���˴������ı��˷�Ӧ��;��������˻�ܣ�
�ʴ�Ϊ��IIʹ���˴������ı��˷�Ӧ��;��������˻�ܣ�
��4��CO2��g��+2NH3��g��=H2NCOONH4��s����H1=-��b-c��KJ/mol��
NH2COONH4��s��$\frac{\underline{\;\;��\;\;}}{\;}$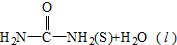 ��H2=+dkJ•mol-1��
��H2=+dkJ•mol-1��
���ݸ�˹���ɢ�+�ڵ�CO2��g��+2NH3��g��=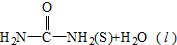 ����÷�Ӧ�ķ�Ӧ��Ϊ����H1+��H2=��-b+c+d��KJ/mol��
����÷�Ӧ�ķ�Ӧ��Ϊ����H1+��H2=��-b+c+d��KJ/mol��
�ʴ�Ϊ��CO2��g��+2NH3��g��=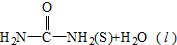 ����H=��-b+c+d��KJ/mol��
����H=��-b+c+d��KJ/mol��
���� ���⿼�����Ȼ�ѧ����ʽ����д����Ӧ�ȵļ��㣬��ȷ��Ӧ������������뷴Ӧ��ЧӦ�Ĺ�ϵ����Ϥ��˹���ɼ��㷴Ӧ�ȵķ����ǽ���ؼ�����Ŀ�еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�92 g NO2��N2O4������庬�е�ԭ����Ϊ6 NA | |
| B�� | 5.6 g������������ϡ���ᷴӦ��ʧȥ�ĵ�����Ϊ0.3 NA | |
| C�� | ��״���£�ll.2 LSO3���еķ�����Ϊ0.5 NA | |
| D�� | 25�桢101 kPaʱ��64 g SO2�к��е���ԭ����Ϊ3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
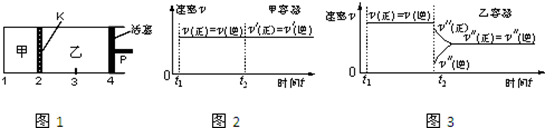
| A�� | �����¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2�� | |
| B�� | ���ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B��������������� | |
| C�� | �����¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2�� | |
| D�� | �����¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ��t1ǰ�ķ�Ӧ���ʱ仯��ʡ�ԣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 67% | B�� | 50% | C�� | 25% | D�� | 10% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
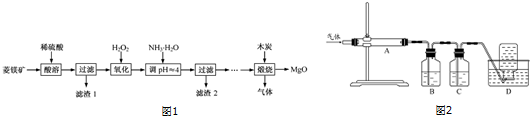
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ?�ܣ���=�ڣ��� | B�� | ?�ܣ��٣���=�� | C�� | ?��=�٣��ڣ��� | D�� | ?��=�ڣ��ܣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
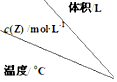 | 1 | 2 | 3 |
| 200 | $\frac{8}{3}$ | $\frac{4}{3}$ | $\frac{8}{9}$ |
| 300 | 2.4 | 1.2 | 0.8 |
| 400 | 2.0 | 1.0 | $\frac{2}{3}$ |
| A�� | m=2����H��0 | |
| B�� | 300��ʱ���÷�Ӧƽ�ⳣ�� K=9 | |
| C�� | ��3L�����н��з�Ӧ���ﵽƽ���ʱ�䣺400�棾200�� | |
| D�� | 200�棬2L�����з�Ӧ��ƽ����ٳ���2 mol Z��ƽ��ʱ Z ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CCl4��Cԭ��sp3�ӻ���Ϊ���������� | |
| B�� | BF3��Bԭ��sp2�ӻ���Ϊƽ�������� | |
| C�� | CS2��Cԭ��sp�ӻ���Ϊֱ���� | |
| D�� | H2S�����У�SΪsp�ӻ���Ϊֱ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com