
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 18gD2O含有10NA个质子 | |
| C. | 标准状况下,2.24L CCl4中含有C-Cl 0.4 NA | |
| D. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
分析 A.1.6g氧气和臭氧的混合物中含有1.6g氧原子,含有0.1mol氧原子;
B.D2O的相对分子质量为20;
C.气体摩尔体积只适用气体;
D.氯气溶于水部分与水反应,且是可逆反应;
解答 解:A.1.6g氧气和臭氧的混合物中含有氧原子的质量为1.6g,含有氧原子的物质的量为0.1mol,含有氧原子的数目为0.1NA,故A正确;
B.18gD2O的物质的量为$\frac{18g}{20g/mol}$=0.9mol,含质子数=0.9mol×10×NA=9NA,故B错误;
C.标况下,四氯化碳为液体,不能适用气体摩尔体积,故C错误;
D.标准状况下,0.1 mol Cl2 溶于水,转移的电子数目小于0.1NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,主要考查溶液离子物质的量计算,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,注意可逆反应的特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
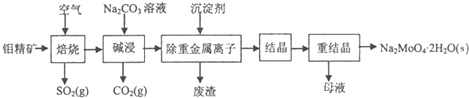
 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质(杂质) | CH3CH2Br (C2H5OH) | C2H5OH (H2O) | CH4 (HCHO) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | |||||
| 分离方法(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
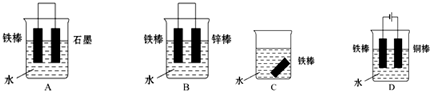
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
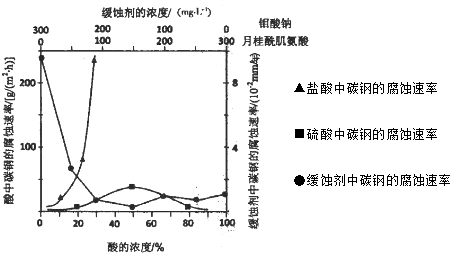
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
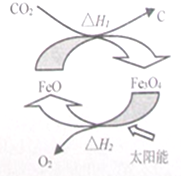 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )| A. | 分解1molFe3O4转移电子数为2NA | |
| B. | 根据盖斯定律可知,△H1+△H2=0 | |
| C. | FeO在CO2转化为C的过程中的作用是催化剂 | |
| D. | CO2中σ键与π键个数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
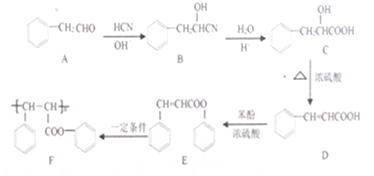
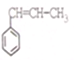 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.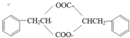 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式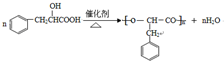 .
.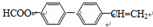 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com