
下列实验操作正确的是( )
A. 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体
B. 使用容量瓶时,先检验其是否漏水,然后洗净后,不用干燥即可使用。
C. 可用10mL量筒量取8.58mL蒸馏水
D. 在配制溶液定容后,上下翻转摇匀后发现液面下降,须加水至溶液凹液面与刻度线相切。
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:2016-2017学年浙江省嘉兴市七校高一上期中化学试卷(解析版) 题型:实验题
实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称取一定质量的硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温;
B.把制得的溶液小心地转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶并轻轻振荡;
E.将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)操作步骤的正确顺序为(填序号) 。
(2)操作A中,在天平上称取硫酸钠固体的质量为 g。
(3)本实验用到的基本仪器已经有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 。
(4)① 在配制溶液过程中,若缺少操作D,将使配制的溶液浓度 (填“偏高”或“偏低”或“无影响”)。② 操作C中加蒸馏水时,不慎超过了刻度线,将使配制的溶液浓度 (填“偏高”或“偏低”或“无影响”)。
(5)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
反应4A(g)+5B(g) 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A.A的平均反应速率是0.010mol·L-1·s-1
B.容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比—定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.3mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
配制0.1mol•L﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是( )
A.3:2 B.2:1 C.1:1 D.2:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
下列表格中除去括号内的杂质,所选试剂和操作方法均正确的是( )
A | KCl(BaCl2) | 加过量K2CO3溶液后过滤,再蒸干滤液. |
B | NaNO3(AgNO3) | 加足量NaCl溶液后过滤,再蒸馏滤液. |
C | NaCl溶液(I2) | 加足量酒精后萃取分液 |
D | KNO3溶液(CCl4) | 直接进行分液操作. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:填空题
工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g) CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是____________(填字母序号)。
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 时数据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=________;a1+a3________1(填“<”、“>”或“=”,)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
下列说法正确的是
A.甲烷燃烧热的数值为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4 kJ/mol
C.相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:填空题
如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。丙池中盛有100 mL 3.00 mol.L-1的CuSO4溶液。试回答下列问题:
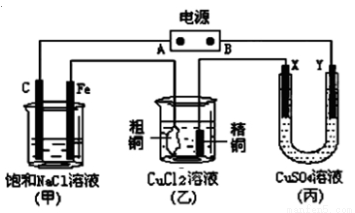
(1)在电源中,B电极为 极(填电极名称,下同);乙装置中粗铜为 极。
(2)在甲装置中,石墨(C)电极上发生 反应(填“氧化”或“还原”);甲装置中总的化学方程式是 。
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为 L。
(4)在丙装置中, X电极上发生的电极反应式是 。
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com