
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
分析 A.氢氧根离子与碳酸氢根离子反应;
B.银离子与氯离子反应生成难溶物氯化银;
C.铵根离子与氢氧根离子反应生成一水合氨;
D.三种离子之间不反应,能够共存.
解答 解:A.OH-、HCO3-之间发生反应,在溶液中不能大量共存,故A错误;
B.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故B错误;
C.NH4+、OH-之间反应生成弱电解质,在溶液中不能大量共存,故C错误;
D.Ba2+、OH-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题有利于培养学生的逻辑推理能力,提高学生的灵活运用能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
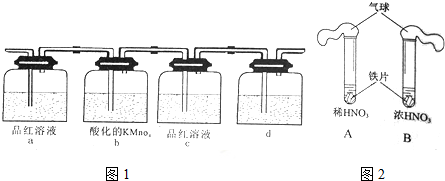
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125.0克CuSO4•5H2O 晶体 | B. | 76.8克无水CuSO4 固体 | ||
| C. | 120.0克CuSO4•5H2O 晶体 | D. | 40.0克无水CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
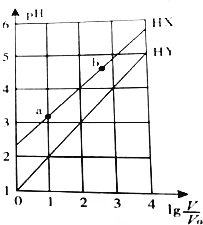
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
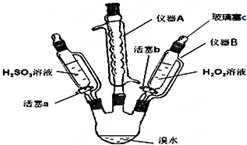 为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com