

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и���1���¿���ѧ�Ծ��������棩 ���ͣ������
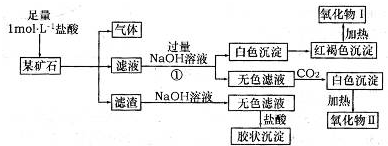
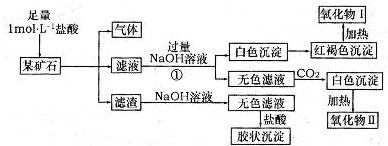
ij��ʯ��������FeCO3��SiO2��Al2O3�е�һ�ֻ�����ɣ�ij�о���ѧϰС����������ɷ֣�ʵ���¼����ͼ��ʾ��
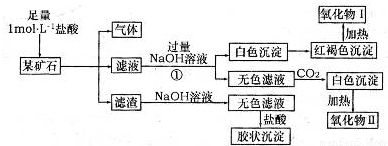
��1���ÿ�ʯ�к��� (�ѧʽ)����д��ʵ����̢��з�Ӧ�����ӷ���ʽ ��
��2�����������������״̬�µ�⣬���Եõ�ij�������ʡ����������ռ�������33��6L(������ɱ�״��)ʱ�������ϵõ��ý��� g��
��3����д���ý�����������I��Ӧ�Ļ�ѧ����ʽ �����÷�Ӧ�IJ�����뵽�����ռ���Һ�У���д��������Ӧ�����ӷ���ʽ ��
��4������һ�������ÿ�ʯ�л���������SrCO3(����������ⲻ��)����(Sr)Ϊ�������ڢ�A��Ԫ�ء�����������ȷ���� (�����)��
���Ȼ���(SrCl2)��Һ������
��SrSO4������ˮ
�۹�ҵ�Ͽ����õ��SrCl2��ˮ��Һ��ȡ������(Sr)
�ܸߴ���ˮ�Ȼ��Ⱦ���(SrCl2��6H2O)������HCl��Χ�м��Ȳ��ܵõ�SrCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�찲��ʡ������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������з�Ӧ�����ӷ���ʽ����д��ȷ����
A��ˮ����ˮ����ʳ�׳�ȥ��2H++ CaCO3= Ca2++CO2��+H2O
2H++Mg(OH)2= Mg2++2H2O
B����84����Һ������Ч�ɷ�HClO���� ������顱����Ҫ�ɷ����ᣩ���ûᵼ�������ж�Cl�C+ClO�C+2H+= Cl2��+H2O
C��SO2ͨ��μӷ�̪��NaOH��Һ�У���ɫ��dz��SO2+2NaOH=Na2SO4+ H2O
D����FeSO4��ȥ���Է�ˮ�е�Cr2O72-��Cr2O72-+Fe2++14H+= 2Cr3++ Fe3++7 H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com