
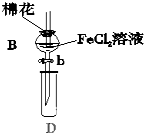
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
分析 Ⅰ.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,则氯气将二价铁氧化成三价铁时,停止通气;
Ⅱ.打开活塞b,使约2ml的溶液流入D试管中,用KSCN溶液来检验溶液中的三价铁离子;
Ⅲ.接着再向B中通入一定量的SO2气体,还原三价铁,生成二价铁和硫酸根;
Ⅳ.更新试管D,重复过程Ⅱ,用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;据此分析解答;
(1)氯气和二氧化硫都是气体且有毒,实验过程中要防止氯气和二氧化硫逸出而污染空气;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气、氯化锰和水;
(3)二氧化硫具有还原性,能和铁离子发生氧化还原反应生成硫酸根离子、亚铁离子和氢离子;实验室用盐酸酸化的氯化钡溶液检验硫酸根离子;
(4)该题的理论依据是氧化还原反应中还原剂的还原性大于还原产物;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫.
解答 解:Ⅰ.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,则氯气将二价铁氧化成三价铁时,停止通气;
Ⅱ.打开活塞b,使约2ml的溶液流入D试管中,用KSCN溶液来检验溶液中的三价铁离子;
Ⅲ.接着再向B中通入一定量的SO2气体,还原三价铁,生成二价铁和硫酸根;
Ⅳ.更新试管D,重复过程Ⅱ,用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;据此分析解答;
(1)氯气和二氧化硫都是气体且有毒,实验过程中要防止氯气和二氧化硫逸出而污染空气,二者都能和NaOH溶液反应产生无毒物质,所以可以用NaOH溶液吸收两种气体,故答案为:NaOH溶液;防止尾气污染环境;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气、氯化锰和水,离子方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)二氧化硫具有还原性,能和铁离子发生氧化还原反应生成硫酸根离子、亚铁离子和氢离子,离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;实验室用盐酸酸化的氯化钡溶液检验硫酸根离子,其检验方法为取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-;
(4)该题的理论依据是氧化还原反应中还原剂的还原性大于还原产物,该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是SO2>Fe2+>Cl-,故答案为:SO2>Fe2+>Cl-;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,
所以一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是乙、丙,
故答案为:乙、丙.
点评 本题以氧化性、还原性比较为载体考查性质实验方案设计,为高频考点,明确实验原理及氧化性、还原性比较方法是解本题关键,侧重考查学生分析判断及总结归纳能力,知道常见的氧化剂和还原剂,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 滴定时,没有逐出滴定管下口的气泡 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
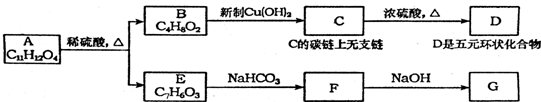
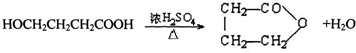 ,反应类型是酯化反应或取代反应.
,反应类型是酯化反应或取代反应.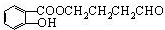 ,E的结构简式是
,E的结构简式是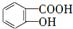 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解 该溶液中一定含有SO42- | |
| B. | 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 该溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 该溶液一定含有CO32- | |
| D. | 向某溶液中加入NaOH浓溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com